از ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده ﺗﺎ ﺗﺨﺖ ﺧﻮاب
(ﺑﺨﺶ دوم)
در اداﻣﻪ ﺑﺤﺚ ﭘﯿﺸﯿﻦ در ﺧﺼﻮص ﻧﻘﺶ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده در ﻋﻤﻠﮑﺮد ﻣﻐﺰ در اﯾﻦ ﻧﻮﺷﺘﺎر ﺑﻪ ﻣﻮﺿﻮﻋﯽ ﻧﻮ در ﺣﻮزه ﻣﻄﺎﻟﻌﺎت ﻣﺤﻮر ﻣﯿﮑﺮوﺑﯿﻮﺗﺎ-روده- ﻣﻐﺰ ﺧﻮاﻫﯿﻢ ﭘﺮداﺧﺖ. ﺧﻮاب ﯾﮏ ﻓﺮآﯾﻨﺪ ﺑﯿﻮﻟﻮژﯾﮑﯽ ﭘﯿﭽﯿﺪه و اﺳﺎﺳﯽ ﺑﺮای ﺳﻼﻣﺖ ﻓﯿﺰﯾﮑﯽ و رواﻧﯽ اﺳﺖ. ﺗﻨﻈﯿﻢ ﺧﻮاب ﺷﺎﻣﻞ ﺗﻌﺎﻣﻞ ﭘﯿﭽﯿﺪه ای از ﺳﯿﺴﺘﻢﻫﺎی ﻧﻮروﺑﯿﻮﻟﻮژﯾﮑﯽ، ﻋﻮاﻣﻞ ﻣﺤﯿﻄﯽ و اﻟﮕﻮﻫﺎی رﻓﺘﺎری اﺳﺖ. ﺗﺤﻘﯿﻘﺎت ﻣﺨﺘﻠﻔﯽ ﻧﺸﺎن داده اﻧﺪ ﮐﻪ ﺧﻮاب ﻣﻨﺎﺳﺐ ﻣﻨﺠﺮ ﺑﻪ ﺗﺮﻣﯿﻢ ﺳﻠﻮلﻫﺎ، ﺑﺎﻓﺖﻫﺎ و ﻋﻀﻼت، ﺗﻘﻮﯾﺖ ﺳﯿﺴﺘﻢ اﯾﻤﻨﯽ و ﮐﻤﮏ ﺑﻪ ﻣﺒﺎرزه ﺑﺎ ﻋﻮاﻣﻞ ﺑﯿﻤﺎریزا، ﮐﺎﻫﺶ ﺧﻄﺮ ﺑﯿﻤﺎریﻫﺎی ﻗﻠﺒﯽ و ﻋﺮوﻗﯽ ﺑﺎ ﺗﻨﻈﯿﻢ ﻓﺸﺎر ﺧﻮن و ﮐﺎﻫﺶ اﻟﺘﻬﺎب، ﮐﺎﻫﺶ ﺧﻄﺮ ﭼﺎﻗﯽ ﺑﺎ ﺗﻨﻈﯿﻢ ﻫﻮرﻣﻮنﻫﺎی ﺗﻨﻈﯿﻢﮐﻨﻨﺪه اﺷﺘﻬﺎ، ﺑﻬﺒﻮد و ﺗﻘﻮﯾﺖ ﻋﻤﻠﮑﺮد ﺷﻨﺎﺧﺘﯽ از ﻗﺒﯿﻞ ﺣﺎﻓﻈﻪ، ﯾﺎدﮔﯿﺮی و ﺣﻞ ﻣﺴﺌﻠﻪ، ﺗﻨﻈﯿﻢ ﺧﻠﻖ وﺧﻮ ﺑﺎ ﮐﺎﻫﺶ اﺳﺘﺮس و ﻫﻤﯿﻨﻄﻮر ﮐﺎﻫﺶ ﺧﻄﺮ اﺑﺘﻼ ﺑﻪ اﺿﻄﺮاب و اﻓﺴﺮدﮔﯽ، ﮐﺎﻫﺶ ﺧﻄﺮ اﺑﺘﻼ ﺑﻪ ﺑﯿﻤﺎریﻫﺎی ﻧﻮرودژﻧﺮاﺗﯿﻮ [1] ﺑﺎ ﭘﺎﮐﺴﺎزی ﻣﺤﺼﻮﻻت زاﺋﺪ ﺗﻮﻟﯿﺪ ﺷﺪه در ﻣﻐﺰ ﺣﯿﻦ ﺑﯿﺪاری و ﮐﺎﻫﺶ اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ [2] ﻣﯽﺷﻮد. ﺑﻨﺎﺑﺮاﯾﻦ ﻫﺮ ﻋﺎﻣﻞ ﻣﺨﺘﻞﮐﻨﻨﺪه ای ﮐﻪ ﮐﯿﻔﯿﺖ و اﻟﮕﻮی ﺧﻮاب را ﺗﺤﺖ ﺗﺄﺛﯿﺮ ﻗﺮار دﻫﺪ ﻣﯽﺗﻮاﻧﺪ ﺗﻬﺪﯾﺪ ﺑﺎﻟﻘﻮهای ﺑﺮای ﺳﻼﻣﺖ ﺗﻠﻘﯽ ﮔﺮدد. ﻫﻤﺎﻧﻄﻮر ﮐﻪ ذﮐﺮ ﮔﺮدﯾﺪ ﻋﻮاﻣﻞ ﻣﺨﺘﻠﻔﯽ در ﺷﮑﻞدﻫﯽ ﺧﻮاب ﺗﻌﯿﯿﻦ ﮐﻨﻨﺪه ﻫﺴﺘﻨﺪ ﮐﻪ واﺟﺪ ﻣﺎﻫﯿﺘﯽ ﭼﻨﺪ وﺟﻬﯽ ﺷﺎﻣﻞ ﺗﻌﺎﻣﻼت ﭘﯿﭽﯿﺪه ﺑﯿﻦ ﻋﻮاﻣﻞ ﻧﻮرواﻧﺪوﮐﺮﯾﻦ [3]، رﯾﺘﻢ ﺷﺒﺎﻧﻪروزی [4]، ﺟﻤﻌﯿﺖﺷﻨﺎﺧﺘﯽ، ﺳﺒﮏ زﻧﺪﮔﯽ و ﺣﺘﯽ رژﯾﻢ ﻏﺬاﯾﯽ ﻣﯽﺷﻮد. درک ﺟﺎﻣﻊ اﯾﻦ ﻋﻮاﻣﻞ ﺑﺮای ﺗﻮﺳﻌﻪ ﻣﺪاﺧﻼت ﻫﺪﻓﻤﻨﺪ ﺑﺮای اﺧﺘﻼﻻت ﺧﻮاب و ارﺗﻘﺎی ﺳﻼﻣﺖ و ﺗﻨﺪرﺳﺘﯽ ﺿﺮوری اﺳﺖ. در اداﻣﻪ ﺑﻪ اﯾﻦ ﺗﻌﯿﯿﻦ ﮐﻨﻨﺪهﻫﺎی ﺧﻮاب ﻣﯽﭘﺮدازﯾﻢ.
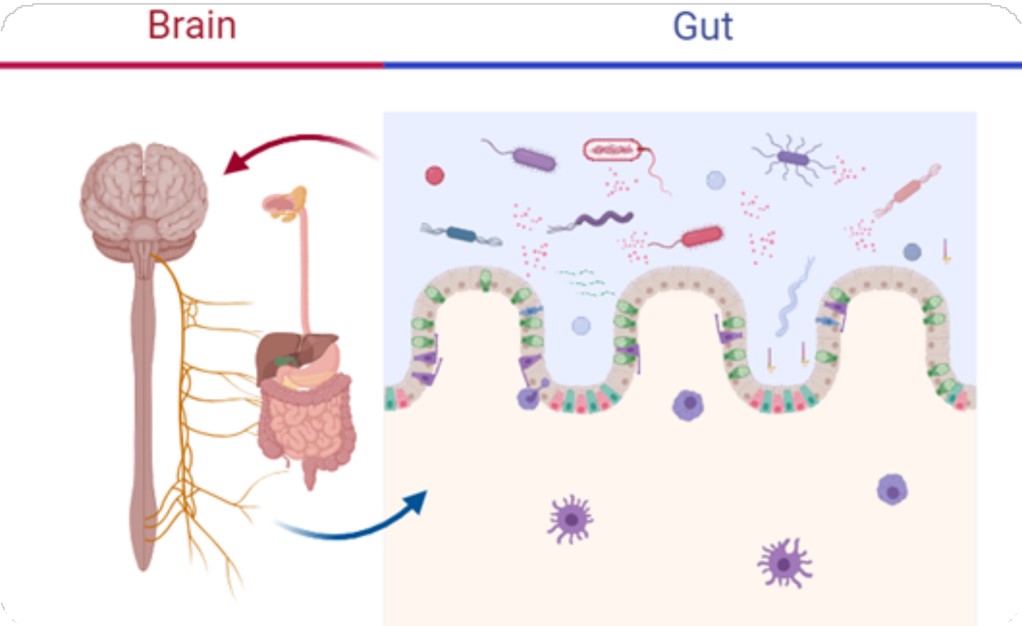
ﺗﺄﺛﯿﺮات ﻫﻮرﻣﻮﻧﯽ، ﻧﻮروﺗﺮاﻧﺴﻤﯿﺘﺮی و ﻣﺤﻮر ﻫﯿﭙﻮﺗﺎﻻﻣﻮس-ﻫﯿﭙﻮﻓﯿﺰ-آدرﻧﺎل ﺑﺮ ﺧﻮاب
ﺗﻨﻈﯿﻢ ﻧﻮرواﻧﺪوﮐﺮﯾﻨﯽ ﺧﻮاب ﻃﯿﻒ ﮔﺴﺘﺮده ای از ﻫﻮرﻣﻮنﻫﺎ را در ﺑﺮ ﻣﯽﮔﯿﺮد ﮐﻪ ﻣﻌﻤﺎری و ﮐﯿﻔﯿﺖ ﺧﻮاب را ﺗﻌﺪﯾﻞ ﻣﯽﮐﻨﻨﺪ. ﻣﻼﺗﻮﻧﯿﻦ، ﺳﻨﺘﺰ ﺷﺪه در ﻏﺪه اﭘﯽﻓﯿﺰ، ﯾﮏ ﺗﻨﻈﯿﻢﮐﻨﻨﺪه ﻣﺤﻮری رﯾﺘﻢ ﺷﺒﺎﻧﻪروزی اﺳﺖ ﮐﻪ ﭼﺮﺧﻪ ﺧﻮاب- ﺑﯿﺪاری را ﺑﺎ ﺳﯿﮕﻨﺎل دﻫﯽ ﺗﺎرﯾﮑﯽ ﻫﻤﺎﻫﻨﮓ ﻣﯽﮐﻨﺪ. اﯾﻦ ﻫﻮرﻣﻮن از ﻃﺮﯾﻖ ﮔﯿﺮﻧﺪهﻫﺎی MT1 و MT2 ﻋﻤﻞ ﻣﯽﮐﻨﺪ و ﺑﺮ ﺗﻤﺎﯾﻞ و ﻣﺪت ﺧﻮاب ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارد. ﻧﻘﺶ آدﻧﻮزﯾﻦ ﻧﯿﺰ ﺑﻪ ﻋﻨﻮان ﯾﮏ ﺗﻌﺪﯾﻞﮐﻨﻨﺪه ﻋﺼﺒﯽ درونزا، در اﻓﺰاﯾﺶ ﻓﺸﺎر ﺧﻮاب از ﻃﺮﯾﻖ ﺗﺠﻤﻊ آن در ﻃﻮل ﺑﯿﺪاری و اﺗﺼﺎل ﺑﻪ ﮔﯿﺮﻧﺪهﻫﺎی A1 و A2A ﺑﺮای ﻣﻬﺎر اﻧﺘﻘﺎل دﻫﻨﺪهﻫﺎی ﻋﺼﺒﯽ ﺗﻘﻮﯾﺖﮐﻨﻨﺪه ﺑﯿﺪاری، ﺣﯿﺎﺗﯽ اﺳﺖ. ﺗﻌﺎﻣﻞ ﺑﯿﻦ ﻧﻮروﺗﺮاﻧﺴﻤﯿﺘﺮﻫﺎی ﺗﺤﺮﯾﮑﯽ (ﻣﺎﻧﻨﺪ ﮔﻠﻮﺗﺎﻣﺎت) و ﻣﻬﺎری (ﮔﺎﺑﺎ) دﯾﻨﺎﻣﯿﮏ ﺧﻮاب را ﺗﺤﺖ ﺗﺄﺛﯿﺮ ﻣﻘﺮار ﻣﯽدﻫﺪ. ﻓﻌﺎﻟﯿﺖ ﮔﺎﺑﺎﺋﺮژﯾﮏ در آﻏﺎز و ﺣﻔﻆ ﺧﻮاب ﺑﺎ ﻣﻬﺎر ﻣﺪارﻫﺎی ﻋﺼﺒﯽ درﮔﯿﺮ در ﺑﯿﺪاری ﺑﺴﯿﺎر ﻣﻬﻢ اﺳﺖ. در ﻣﻘﺎﺑﻞ، ﻣﻮﻧﻮآﻣﯿﻦﻫﺎ ﻣﺎﻧﻨﺪ ﻧﻮراﭘﯽﻧﻔﺮﯾﻦ و ﺳﺮوﺗﻮﻧﯿﻦ، اﮔﺮﭼﻪ ﻣﻌﻤﻮﻻً ﺑﺎ ﺣﺎﻟﺖﻫﺎی ﺑﯿﺪاری ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ، اﻣﺎ ﻧﻘﺶﻫﺎی ﻇﺮﯾﻔﯽ در ﺗﻨﻈﯿﻢ ﺧﻮاب دارﻧﺪ، ﺑﻪ ﻃﻮر ﻣﺜﺎل ﺑﺎ ﻓﻌﺎﻟﯿﺖ ﺳﺮوﺗﻮﻧﺮژﯾﮏ ﮐﻪ ﭼﺮﺧﻪﻫﺎی ﺧﻮاب ﻣﻮج آﻫﺴﺘﻪ [5] (SWS) و ﺣﺮﮐﺖ ﺳﺮﯾﻊ ﭼﺸﻢ [6] (REM) را ﺗﻌﺪﯾﻞ ﻣﯽﮐﻨﺪ. ﻫﻮرﻣﻮنﻫﺎی ﺗﻮﻟﯿﺪﻣﺜﻠﯽ ﯾﺎ ﻣﺮﺗﺒﻂ ﺑﺎ ﺗﻮﻟﯿﺪﻣﺜﻞ (ﻣﺎﻧﻨﺪ اﺳﺘﺮوژن و ﭘﺮوﻻﮐﺘﯿﻦ) ﻣﯽﺗﻮاﻧﻨﺪ ﺑﻪ وﯾﮋه در راﺑﻄﻪ ﺑﺎ ﭘﺎﺳﺦﻫﺎی اﺳﺘﺮس و ﭼﺮﺧﻪﻫﺎی ﺗﻮﻟﯿﺪﻣﺜﻠﯽ، ﺑﺮ اﻟﮕﻮﻫﺎی ﺧﻮاب ﺗﺄﺛﯿﺮ ﻗﺎﺑﻞ ﺗﻮﺟﻬﯽ داﺷﺘﻪ ﺑﺎﺷﻨﺪ. ﻣﺤﻮر HPA ﻧﻘﺶ ﻣﺮﮐﺰی در ﭘﺎﺳﺦ ﺑﻪ اﺳﺘﺮس دارد و ﭘﯿﺎﻣﺪﻫﺎی ﻣﻬﻤﯽ ﺑﺮای ﺗﻨﻈﯿﻢ ﺧﻮاب دارد. ﻓﻌﺎلﺳﺎزی اﯾﻦ ﻣﺤﻮر ﻣﻨﺠﺮ ﺑﻪ ﺗﺮﺷﺢ ﻫﻮرﻣﻮن آزادﮐﻨﻨﺪه ﮐﻮرﺗﯽ ﮐﻮﺗﺮوﭘﯿﻦ (CRH) از ﻫﯿﭙﻮﺗﺎﻻﻣﻮس، ﺗﺤﺮﯾﮏ ﺗﺮﺷﺢ ﻫﻮرﻣﻮن آدرﻧﻮﮐﻮرﺗﯿﮑﻮﺗﺮوﭘﯿﮏ (ACTH) از ﻫﯿﭙﻮﻓﯿﺰ و در ﻧﺘﯿﺠﻪ آزادﺳﺎزی ﮔﻠﻮﮐﻮﮐﻮرﺗﯿﮑﻮﺋﯿﺪ از ﻗﺸﺮ آدرﻧﺎل ﻣﯽﺷﻮد. ﮔﻠﻮﮐﻮﮐﻮرﺗﯿﮑﻮﺋﯿﺪﻫﺎ، ﺑﻪ وﯾﮋه ﮐﻮرﺗﯿﺰول، ﺗﺄﺛﯿﺮ ﭘﯿﭽﯿﺪه ای ﺑﺮ ﺧﻮاب دارﻧﺪ و ﻣﻌﻤﻮﻻً ﺷﺮوع ﺧﻮاب را ﺑﻪ ﺗﺄﺧﯿﺮ ﻣﯽاﻧﺪازﻧﺪ و SWS را از ﻃﺮﯾﻖ اﺛﺮات ﺧﻮد ﺑﺮ ﺳﯿﺴﺘﻢ ﻋﺼﺒﯽ ﻣﺮﮐﺰی ﮐﺎﻫﺶ ﻣﯽدﻫﻨﺪ. ﻓﻌﺎلﺳﺎزی ﻣﺰﻣﻦ ﻣﺤﻮر HPA، ﻫﻤﺎﻧﻄﻮر ﮐﻪ در ﺷﺮاﯾﻂ اﺳﺘﺮس ﻣﺰﻣﻦ دﯾﺪه ﻣﯽﺷﻮد، ﻣﯽﺗﻮاﻧﺪ ﻣﻨﺠﺮ ﺑﻪ اﺧﺘﻼل در ﭼﺮﺧﻪ ﺧﻮاب-ﺑﯿﺪاری ﺷﻮد و ﺑﻪ ﺗﻮﺳﻌﻪ و ﺣﻔﻆ ﺑﯽﺧﻮاﺑﯽ ﮐﻤﮏ ﮐﻨﺪ. ﺑﺎزﺧﻮرد ﺑﺎزدارﻧﺪه ﻣﺤﻮر HPA ﺗﻮﺳﻂ ﮐﻮرﺗﯿﺰول ﺣﯿﺎﺗﯽ اﺳﺖ؛ ﺑﺎ اﯾﻦ ﺣﺎل، اﺧﺘﻼل در اﯾﻦ ﺣﻠﻘﻪ ﺑﺎزﺧﻮرد [7]، ﮐﻪ اﻏﻠﺐ در اﺧﺘﻼﻻت رواﻧﭙﺰﺷﮑﯽ ﻣﺎﻧﻨﺪ اﻓﺴﺮدﮔﯽ و اﺿﻄﺮاب ﻣﺸﺎﻫﺪه ﻣﯽﺷﻮد، اﺧﺘﻼﻻت ﺧﻮاب را ﺗﺸﺪﯾﺪ ﻣﯽﮐﻨﺪ.
ﺗﺄﺛﯿﺮات ﺟﻤﻌﯿﺖﺷﻨﺎﺧﺘﯽ و ﺳﺒﮏ زﻧﺪﮔﯽ ﺑﺮ ﺧﻮاب
ﻋﻮاﻣﻞ ﺟﻤﻌﯿﺖﺷﻨﺎﺧﺘﯽ از ﺟﻤﻠﻪ ﺳﻦ، ﺟﻨﺴﯿﺖ و وﺿﻌﯿﺖ ﺷﻐﻠﯽ ﺑﺮ اﻟﮕﻮﻫﺎ و ﮐﯿﻔﯿﺖ ﺧﻮاب ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارﻧﺪ. ﺗﻐﯿﯿﺮات ﻣﺮﺗﺒﻂ ﺑﺎ ﺳﻦ در ﻣﻌﻤﺎری ﺧﻮاب، ﻣﺎﻧﻨﺪ ﮐﺎﻫﺶ SWS و اﻓﺰاﯾﺶ ﺗﮑﻪﺗﮑﻪ ﺷﺪن ﺧﻮاب، ﺑﻪ ﺧﻮﺑﯽ ﻣﺴﺘﻨﺪ ﺷﺪه اﺳﺖ. اﯾﻦ ﺗﻐﯿﯿﺮات ﺗﺎ ﺣﺪی ﺑﻪ ﺗﻐﯿﯿﺮات در رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی و ﮐﺎﻫﺶ ﻓﺸﺎر ﺧﻮاب ﻧﺴﺒﺖ داده ﻣﯽﺷﻮد. ﺗﻔﺎوتﻫﺎی ﺟﻨﺴﯿﺘﯽ در ﺧﻮاب ﻧﯿﺰ ﻗﺎﺑﻞ ﺗﻮﺟﻪ اﺳﺖ. زﻧﺎن ﻋﻤﻮﻣﺎً اﺧﺘﻼﻻت ﺧﻮاب ﺑﯿﺸﺘﺮی را ﮔﺰارش ﻣﯽﮐﻨﻨﺪ ﮐﻪ ﻣﻤﮑﻦ اﺳﺖ ﺑﻪ ﻧﻮﺳﺎﻧﺎت ﻫﻮرﻣﻮﻧﯽ در ﻃﻮل ﭼﺮﺧﻪ ﻗﺎﻋﺪﮔﯽ، ﺑﺎرداری و ﯾﺎﺋﺴﮕﯽ ﻣﺮﺗﺒﻂ ﺑﺎﺷﺪ. ﻋﻮاﻣﻞ ﺷﻐﻠﯽ، ﺑﻪ وﯾﮋه آﻧﻬﺎﯾﯽ ﮐﻪ ﺷﺎﻣﻞ ﺳﺎﻋﺎت ﻧﺎﻣﻨﻈﻢ ﯾﺎ ﺷﯿﻔﺖ ﺷﺐ ﻫﺴﺘﻨﺪ، ﻫﻤﺎﻫﻨﮕﯽ ﺷﺒﺎﻧﻪروزی را ﻣﺨﺘﻞ ﻣﯽﮐﻨﻨﺪ و ﺑﺎ اﻓﺰاﯾﺶ ﺷﯿﻮع اﺧﺘﻼﻻت ﺧﻮاب، اﺧﺘﻼل در ﻋﻤﻠﮑﺮد ﺷﻨﺎﺧﺘﯽ و ﺧﻄﺮ ﺑﺎﻻﺗﺮ ﺑﺮای ﺑﯿﻤﺎریﻫﺎی ﻣﺰﻣﻦ ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ.
ﻣﺼﺮف ﻏﺬا، ﮔﺮﺳﻨﮕﯽ و ﺳﯿﺮی: ﺗﺄﺛﯿﺮات ﻣﺘﺎﺑﻮﻟﯿﮑﯽ ﺑﺮ ﺧﻮاب
راﺑﻄﻪ ﺑﯿﻦ ﻣﺼﺮف ﻏﺬا و ﺧﻮاب ﺑﻪ ﻃﻮر ﻓﺰاﯾﻨﺪه ای ﺑﻪ ﻋﻨﻮان دو ﻃﺮﻓﻪ ﺷﻨﺎﺧﺘﻪ ﻣﯽﺷﻮد. ﻫﻮرﻣﻮنﻫﺎی درﮔﯿﺮ در ﺗﻨﻈﯿﻢ ﮔﺮﺳﻨﮕﯽ و ﺳﯿﺮی، ﻣﺎﻧﻨﺪ ﻟﭙﺘﯿﻦ، ﮔﺮﻟﯿﻦ و اﻧﺴﻮﻟﯿﻦ، ﻧﻪ ﺗﻨﻬﺎ ﺑﺮ ﺗﻌﺎدل اﻧﺮژی ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارﻧﺪ، ﺑﻠﮑﻪ ﺑﺮ ﻣﻌﻤﺎری ﺧﻮاب ﻧﯿﺰ اﺛﺮ دارﻧﺪ. ﻟﭙﺘﯿﻦ، ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻫﻮرﻣﻮن آﻧﻮرﮐﺴﯿﮋﻧﯿﮏ، ﺧﻮاب را ﺗﻘﻮﯾﺖ ﻣﯽﮐﻨﺪ، در ﺣﺎﻟﯽ ﮐﻪ ﮔﺮﻟﯿﻦ، ﯾﮏ ﻫﻮرﻣﻮن اﺷﺘﻬﺎآور، ﺑﺎ اﻓﺰاﯾﺶ ﺑﯿﺪاری ﻣﺮﺗﺒﻂ اﺳﺖ. اﻟﮕﻮﻫﺎی ﻏﺬاﯾﯽ و ﻣﻮاد ﻣﻐﺬی ﺧﺎص ﻧﯿﺰ ﻧﻘﺶ ﻣﻬﻤﯽ در ﺗﻨﻈﯿﻢ ﺧﻮاب دارﻧﺪ. ﺑﻪ ﻋﻨﻮان ﻣﺜﺎل، رژﯾﻢﻫﺎی ﻏﺬاﯾﯽ ﭘﺮﭼﺮب و ﻗﻨﺪی ﺑﺎ ﮐﯿﻔﯿﺖ ﺧﻮاب ﭘﺎﯾﯿﻦﺗﺮ ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ، در ﺣﺎﻟﯽ ﮐﻪ رژﯾﻢﻫﺎی ﻏﺬاﯾﯽ ﻏﻨﯽ از ﻓﯿﺒﺮ و ﭘﺮوﺗﺌﯿﻦﻫﺎی ﮐﻢ ﭼﺮب ﺑﺎ ﻧﺘﺎﯾﺞ ﺧﻮاب ﺑﻬﺘﺮ ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ. زﻣﺎن وﻋﺪهﻫﺎی ﻏﺬاﯾﯽ، ﺑﻪ وﯾﮋه ﺧﻮردن دﯾﺮﻫﻨﮕﺎم ﺷﺐ، ﻣﯽﺗﻮاﻧﺪ رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی را ﻣﺨﺘﻞ ﮐﺮده و ﺑﺮ ﺧﻮاب ﺗﺄﺛﯿﺮ ﻣﻨﻔﯽ ﺑﮕﺬارد.
رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی: ﻣﮑﺎﻧﯿﺴﻢﻫﺎی ﻣﻮﻟﮑﻮﻟﯽ و ﺗﻨﻈﯿﻢ ﺧﻮاب
رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی ﭼﺮﺧﻪﻫﺎی ﺗﻘﺮﯾﺒﺎً ۲۴ ﺳﺎﻋﺘﻪ درونزا ﻫﺴﺘﻨﺪ ﮐﻪ ﻓﺮآﯾﻨﺪﻫﺎی ﻓﯿﺰﯾﻮﻟﻮژﯾﮏ ﻣﺨﺘﻠﻒ از ﺟﻤﻠﻪ ﭼﺮﺧﻪ ﺧﻮاب-ﺑﯿﺪاری را ﺗﻨﻈﯿﻢ ﻣﯽﮐﻨﻨﺪ. اﯾﻦ رﯾﺘﻢﻫﺎ ﺗﻮﺳﻂ ﻣﺠﻤﻮﻋﻪای از ژنﻫﺎی ﺳﺎﻋﺖ [1] اﺻﻠﯽ از ﺟﻤﻠﻪ PER ،BMAL1 ،CLOCK و CRY ﻫﺪاﯾﺖ ﻣﯽﺷﻮﻧﺪ ﮐﻪ ﻧﻮﺳﺎﻧﺎت را از ﻃﺮﯾﻖ ﺣﻠﻘﻪﻫﺎی ﺑﺎزﺧﻮرد روﻧﻮﯾﺴﯽ-ﺗﺮﺟﻤﻪ اﯾﺠﺎد ﻣﯽﮐﻨﻨﺪ. ﻫﺴﺘﻪ ﺳﻮﭘﺮاﮐﯿﺎﺳﻤﺎﺗﯿﮏ (SCN) ﻫﯿﭙﻮﺗﺎﻻﻣﻮس ﺑﻪ ﻋﻨﻮان ﺳﺎﻋﺖ اﺻﻠﯽ و ﻣﺮﮐﺰی [8] ﻋﻤﻞ ﻣﯽﮐﻨﺪ و ﺳﺎﻋﺖﻫﺎی ﻣﺤﯿﻄﯽ [9] را در ﺑﺎﻓﺖﻫﺎی ﻣﺨﺘﻠﻒ ﻧﻈﯿﺮ ﮐﺒﺪ، ﻗﻠﺐ، ﺑﺎﻓﺖ ﭼﺮﺑﯽ، دﺳﺘﮕﺎه ﮔﻮارش و ... ﻫﻤﮕﺎم ﻣﯽﮐﻨﺪ. اﺧﺘﻼﻻت در رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی، ﭼﻪ ﺑﻪ دﻟﯿﻞ ﺟﻬﺶﻫﺎی ژﻧﺘﯿﮑﯽ و ﯾﺎ ﻋﻮاﻣﻞ ﻣﺤﯿﻄﯽ ﻣﺎﻧﻨﺪ ﻗﺮار ﮔﺮﻓﺘﻦ در ﻣﻌﺮض ﻧﻮر ﯾﺎ اﻟﮕﻮﻫﺎی رﻓﺘﺎری ﻣﺎﻧﻨﺪ ﮐﺎر ﺷﯿﻔﺘﯽ، ﻣﯽﺗﻮاﻧﺪ ﻣﻨﺠﺮ ﺑﻪ ﻧﺎﻫﻤﺎﻫﻨﮕﯽ ﺳﺎﻋﺖ داﺧﻠﯽ ﺷﻮد. اﯾﻦ ﻧﺎﻫﻤﺎﻫﻨﮕﯽ ﺑﺎ اﺧﺘﻼﻻت ﺧﻮاب ﻣﺨﺘﻠﻒ از ﺟﻤﻠﻪ اﺧﺘﻼل ﻓﺎز ﺧﻮاب ﺗﺎﺧﯿﺮی [10] و ﻫﻤﭽﻨﯿﻦ ﻣﺴﺎﺋﻞ ﮔﺴﺘﺮدهﺗﺮ ﺳﻼﻣﺘﯽ ﻣﺎﻧﻨﺪ ﺳﻨﺪرم ﻣﺘﺎﺑﻮﻟﯿﮏ و اﺧﺘﻼﻻت ﺧﻠﻘﯽ ﻣﺮﺗﺒﻂ اﺳﺖ.
ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده و ﺧﻮاب
ﺗﺎ اﯾﻨﺠﺎ ﮐﻪ ﺷﺮﺣﯽ ﮐﻠﯽ از اﻫﻤﯿﺖ ﺧﻮاب و ﻋﻮاﻣﻞ ﻣﻮﺛﺮ ﺑﺮ آن اراﺋﻪ ﺷﺪ و اﮔﺮ ﻧﻮﺷﺘﺎر ﭘﯿﺸﯿﻦ در ﺧﺼﻮص ﻧﺤﻮه ارﺗﺒﺎط ﻣﻐﺰ و ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده در ﺧﺎﻃﺮﺗﺎن ﺑﺎﺷﺪ، ﺣﺪس ﺧﻮاﻫﯿﺪ زد ﮐﻪ ﻣﺴﯿﺮﻫﺎی روﺷﻨﯽ وﺟﻮد دارد ﮐﻪ ﻣﯽﺗﻮاﻧﺪ ﺑﻪ ﻋﻨﻮان ﯾﮏ واﺳﻄﻪ ﺑﯿﻦ ﺧﻮاب و ﻓﻌﺎﻟﯿﺖ ﻣﯿﮑﺮوﺑﯽ دﺳﺘﮕﺎه ﮔﻮارش ﻋﻤﻞ ﮐﻨﺪ، ﻧﻈﯿﺮ اﻟﺘﻬﺎب، ﻋﺼﺐ واگ، ﻣﺘﺎﺑﻮﻟﯿﺖﻫﺎی ﺑﺎﮐﺘﺮﯾﺎﯾﯽ و ﻣﺤﻮر HPA. اﻣﺎ ﺷﻮاﻫﺪ ﺟﺎﻟﺐ دﯾﮕﺮی ﻧﯿﺰ وﺟﻮد دارد ﮐﻪ ﻟﺰوم ﭼﻨﯿﻦ ارﺗﺒﺎﻃﯽ را ﺗﻘﻮﯾﺖ ﻣﯽﮐﻨﺪ. ﺗﺤﻘﯿﻘﺎت ﻣﺨﺘﻠﻔﯽ ﮔﺰارش داده اﻧﺪ ﮐﻪ ﺑﺎﮐﺘﺮیﻫﺎی دﺳﺘﮕﺎه ﮔﻮارش ﻧﯿﺰ ﻣﺎﻧﻨﺪ ﭼﺮﺧﻪ ﺧﻮاب و ﺑﯿﺪاری ﻣﺎ از ﯾﮏ ﺳﯿﮑﻞ ﺷﺒﺎﻧﻪ روزی ﭘﯿﺮوی ﻣﯽﮐﻨﻨﺪ. در ﻣﻮشﻫﺎ و اﻧﺴﺎنﻫﺎ، ﺑﺮﺧﯽ از اﻧﻮاع ﺑﺎﮐﺘﺮیﻫﺎ در ﻃﻮل روز ﺗﻐﯿﯿﺮ ﺗﻌﺪاد ﻣﯽدﻫﻨﺪ و ﯾﺎ ﺑﺮﺧﯽ ﺑﺎﮐﺘﺮیﻫﺎ در ﻃﻮل روز ﻓﻌﺎلﺗﺮ ﻫﺴﺘﻨﺪ و ﺑﺮﺧﯽ دﯾﮕﺮ در ﺷﺐ. ﺑﻨﺎﺑﺮاﯾﻦ ﻧﻮﺳﺎﻧﺎت رﯾﺘﻤﯿﮏ در ﻣﯿﮑﺮوﺑﻮﺗﺎی روده ﺷﺎﻣﻞ رﯾﺘﻢ ﺟﻤﻌﯿﺘﯽ و رﯾﺘﻢ ﻋﻤﻠﮑﺮدی اﺳﺖ. ﺑﻄﻮر ﻣﺜﺎل در ﻣﻮشﻫﺎ ﺑﺎﮐﺘﺮیﻫﺎﯾﯽ ﻣﺎﻧﻨﺪ ﮐﻠﺴﺘﺮﯾﺪﯾﺎلﻫﺎ [11] و ﻻﮐﺘﻮﺑﺎﺳﯿﻞﻫﺎ [12] ﺑﺎ ﺗﻮﺟﻪ ﺑﻪ ﭼﺮﺧﻪ ۲۴ ﺳﺎﻋﺘﻪ ﺗﻐﯿﯿﺮ ﺗﻌﺪاد ﻣﯽدﻫﻨﺪ و در اﻧﺴﺎنﻫﺎ: ﺑﺎﮐﺘﺮیﻫﺎﯾﯽ ﻣﺎﻧﻨﺪ ﭘﺎراﺑﺎﮐﺘﺮوﺋﯿﺪﻫﺎ [13] و روزﺑﻮرﯾﺎ [14] ﻧﯿﺰ ﻧﻮﺳﺎﻧﺎت روزاﻧﻪ را ﻧﺸﺎن ﻣﯽدﻫﻨﺪ. ﻫﻤﭽﻨﯿﻦ ﮔﺰارشﻫﺎی دﯾﮕﺮ ﺣﺎﮐﯽ از ﺗﻐﯿﯿﺮ در ﻓﻌﺎﻟﯿﺖ اﻧﺘﺮوﺑﺎﮐﺘﺮ آﺋﺮوژﻧﺰ [15] ﺑﺼﻮرت روزاﻧﻪ و ﺗﻐﯿﯿﺮ ﺗﻌﺪاد ﻣﻮﮐﻮﺳﭙﯿﺮﯾﻠﻮم ﺷﺎدﻟﺮی [16] ﺑﯿﻦ دورهﻫﺎی روﺷﻨﺎﯾﯽ و ﺗﺎرﯾﮑﯽ اﺳﺖ. ﻫﻤﭽﻨﯿﻦ ﮔﺰارش ﺷﺪه ﮐﻪ در ﻣﻮشﻫﺎ، ﺑﺎﮐﺘﺮیﻫﺎی روده ﻫﻨﮕﺎم ﻓﻌﺎﻟﯿﺖ (ﻣﻌﻤﻮﻻً در ﺷﺐ) ﺑﺮ روی اﺳﺘﻔﺎده از اﻧﺮژی و رﺷﺪ ﺳﻠﻮﻟﯽ ﺗﻤﺮﮐﺰ ﻣﯽﮐﻨﻨﺪ و ﻫﻨﮕﺎم اﺳﺘﺮاﺣﺖ (در ﻃﻮل روز) ﺑﺮ روی ﺣﻔﻆ اﻧﺮژی ﻣﺘﻤﺮﮐﺰ ﻫﺴﺘﻨﺪ.
ﻋﻮاﻣﻞ ﻣﺘﻨﻮﻋﯽ ﻣﺎﻧﻨﺪ ﺗﻐﯿﯿﺮات ژﻧﺘﯿﮑﯽ، رژﯾﻢ ﻏﺬاﯾﯽ و ﻗﺮار ﮔﺮﻓﺘﻦ در ﻣﻌﺮض ﻧﻮر ﻣﯽﺗﻮاﻧﻨﺪ اﯾﻦ رﯾﺘﻢﻫﺎی روزاﻧﻪ را ﻣﺨﺘﻞ ﮐﻨﻨﺪ. ﻏﺬاﻫﺎی ﻣﺨﺘﻠﻒ ﻣﯽﺗﻮاﻧﻨﺪ ﺑﺮ ﻧﺤﻮه و زﻣﺎن ﺗﻐﯿﯿﺮ ﺑﺎﮐﺘﺮیﻫﺎی روده ﺗﺄﺛﯿﺮ ﺑﮕﺬارﻧﺪ. ﺑﻪ ﻋﻨﻮان ﻣﺜﺎل، ﺑﺎﮐﺘﺮیﻫﺎﯾﯽ ﮐﻪ از ﮐﺮﺑﻮﻫﯿﺪرات اﺳﺘﻔﺎده ﻣﯽﮐﻨﻨﺪ ﻣﻤﮑﻦ اﺳﺖ ﺑﻪ ﺗﻐﯿﯿﺮات در اﻟﮕﻮﻫﺎی ﻏﺬاﯾﯽ ﭘﺎﺳﺦ ﻣﺘﻔﺎوﺗﯽ دﻫﻨﺪ. رﯾﺘﻢﻫﺎی ﻣﯿﮑﺮوﺑﯽ ﺑﻪ ﻃﻮر ﻧﺰدﯾﮑﯽ ﺑﺎ رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی ﻣﯿﺰﺑﺎن ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ. اﯾﻦ اﻟﮕﻮﻫﺎی روزاﻧﻪ ﺑﺎﮐﺘﺮیﻫﺎ ﺗﺤﺖ ﺗﺄﺛﯿﺮ ﻣﻼﺗﻮﻧﯿﻦ و دﻣﺎ ﻗﺮار ﻣﯽﮔﯿﺮد ﮐﻪ ﻫﻤﯿﻦ ﻋﻮاﻣﻞ، ﺳﺎﻋﺖ داﺧﻠﯽ ﻣﺎ را ﻧﯿﺰ ﺗﻨﻈﯿﻢ ﻣﯽﮐﻨﻨﺪ. اﺧﺘﻼﻻت در ژنﻫﺎی ﺳﺎﻋﺖ ﺷﺒﺎﻧﻪروزی ﻣﯿﺰﺑﺎن ﻣﺜﻼً ﺟﻬﺶﻫﺎی Clock ﻣﯽﺗﻮاﻧﻨﺪ رﯾﺘﻢﻫﺎی ﻣﯿﮑﺮوﺑﯽ را ﺗﺤﺖ ﺗﺄﺛﯿﺮ ﻗﺮار دﻫﻨﺪ، ﺣﺘﯽ اﮔﺮ رﻓﺘﺎر ﻣﯿﺰﺑﺎن ﻃﺒﯿﻌﯽ ﺑﺎﺷﺪ. ﻗﺎﺑﻞ ﺗﻮﺟﻪ اﺳﺖ ﮐﻪ دﯾﺪه ﺷﺪه ﺗﻨﻈﯿﻢ زﻣﺎن وﻋﺪهﻫﺎی ﻏﺬاﯾﯽ ﻣﯽﺗﻮاﻧﺪ رﯾﺘﻢﻫﺎی ﺑﺎﮐﺘﺮﯾﺎﯾﯽ ﺳﺎﻟﻢ را در ﻣﻮشﻫﺎی دارای ﺟﻬﺶ در ژن Clock ﺑﺎزﮔﺮداﻧﺪ و ﻧﺸﺎن ﻣﯽدﻫﺪ ﮐﻪ زﻣﺎنﺑﻨﺪی ﻏﺬا ﯾﮏ ﻋﺎﻣﻞ ﻣﻬﻢ در ﺗﻨﻈﯿﻢ ﺑﺎﮐﺘﺮیﻫﺎی روده اﺳﺖ ﮐﻪ ﻣﺴﺘﻘﻞ از ﺳﺎﻋﺖ داﺧﻠﯽ ﻣﯿﺰﺑﺎن ﻋﻤﻞ ﻣﯽﮐﻨﺪ. از ﻇﺮﻓﯽ ﺑﺎﯾﺪ ﺗﻮﺟﻪ داﺷﺖ ﮐﻪ ﻧﻮﺳﺎﻧﺎت در ﺑﺎﮐﺘﺮیﻫﺎی روده ﺑﺮ ﻫﻀﻢ، ﺗﻌﺎدل اﻧﺮژی و ﻣﺘﺎﺑﻮﻟﯿﺴﻢ ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارﻧﺪ. ﻣﺘﺎﺑﻮﻟﯿﺖﻫﺎی ﺑﺎﮐﺘﺮﯾﺎﯾﯽ ﮐﻪ ﺑﻪ ﺻﻮرت رﯾﺘﻤﯿﮏ ﺗﻮﻟﯿﺪ ﻣﯽﺷﻮﻧﺪ، ﻣﯽﺗﻮاﻧﻨﺪ ﺑﺮ رﯾﺘﻢﻫﺎی ﺷﺒﺎﻧﻪروزی و ﻣﺘﺎﺑﻮﻟﯿﺴﻢ ﻣﯿﺰﺑﺎن ﺗﺄﺛﯿﺮ ﺑﮕﺬارﻧﺪ. ﺑﻪ ﻋﻨﻮان ﻣﺜﺎل، ﮐﻮﻟﯿﻦ ﻏﺬاﯾﯽ ﺗﻮﺳﻂ ﺑﺎﮐﺘﺮیﻫﺎی روده ﺑﻪ ﺗﺮی ﻣﺘﯿﻞآﻣﯿﻦ و ﺳﭙﺲ ﺑﻪ ﺗﺮی ﻣﺘﯿﻞآﻣﯿﻦ ان-اﮐﺴﯿﺪ (TMAO) [17] ﺗﺒﺪﯾﻞ ﻣﯽﺷﻮد ﮐﻪ ﻣﻤﮑﻦ اﺳﺖ ﺑﺮ ﺑﯿﺎن ژنﻫﺎی ﺳﺎﻋﺖ ﺷﺒﺎﻧﻪروزی ﺗﺄﺛﯿﺮ ﺑﮕﺬارد. ﺑﻨﺎﺑﺮ ﯾﺎﻓﺘﻪﻫﺎی ذﮐﺮ ﺷﺪه ﻣﯽﺗﻮان ﻧﺘﯿﺠﻪ ﮔﺮﻓﺖ ﮐﻪ ﯾﮑﯽ از ﭼﺎﻟﺶﻫﺎی ﻣﻄﺎﻟﻌﺎت ﻣﺘﻤﺮﮐﺰ ﺑﺮ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎ، زﻣﺎن ﻧﻤﻮﻧﻪﮔﯿﺮی اﺳﺖ زﯾﺮا اﯾﻦ اﺣﺘﻤﺎل وﺟﻮد دارد ﮐﻪ در زﻣﺎن ﻣﺘﻔﺎوت ﺗﻌﺪاد ﺑﺎﮐﺘﺮیﻫﺎ ﻣﺘﻐﯿﺮ ﺑﺎﺷﺪ. در ﺗﺤﻘﯿﻘﯽ از دو ﻓﺮد ﮐﻪ ﺳﻔﺮی 8 و 10 ﺳﺎﻋﺘﻪ ﻫﻤﺮاه ﺑﺎ ﭘﺪﯾﺪه ﺟﺖ-ﻟﮓ [18] در ﭘﯿﺶ داﺷﺘﻨﺪ در ﺳﻪ ﺷﺮاﯾﻂ ﭘﯿﺶ از ﺳﻔﺮ، ﯾﮏ روز ﭘﺶ از ﺳﻔﺮ (ﺣﯿﻦ ﺟﺖ-ﻟﮓ) و دو ﻫﻔﺘﻪ ﭘﺲ از ﺳﻔﺮ(رﯾﮑﺎوری) ﻧﻤﻮﻧﻪ ﻣﺪﻓﻮع ﮔﺮﻓﺘﻪ و ﺑﻪ ﻣﻮشﻫﺎی germ-free ﭘﯿﻮﻧﺪ زده ﺷﺪ و ﺳﭙﺲ اﻓﺰاﯾﺶ وزن و ﻗﻨﺪ ﺧﻮن ﻣﻮشﻫﺎ اﻧﺪازهﮔﯿﺮی ﺷﺪ.
آﻧﺎﻟﯿﺰ ﻣﺪﻓﻮع اﻓﺮاد ﻧﺸﺎن داد ﮐﻪ ﺟﺖ-ﻟﮓ ﻣﻨﺠﺮ ﺑﻪ ﺗﻐﯿﯿﺮ در ﻓﺮاواﻧﯽ ﻓﯿﺮﻣﯿﮑﻮﺗﺲﻫﺎ [19] ﻣﯽﺷﻮد ﮐﻪ ﭘﺲ از رﯾﮑﺎوری اﯾﻦ ﺗﻐﯿﯿﺮ ﺑﻪ ﺣﺎﻟﺖ ﻧﺮﻣﺎل ﻗﺒﻞ از ﺟﺖ-ﻟﮓ ﺑﺎزﮔﺸﺖ. ﻫﻤﭽﻨﯿﻦ ﻣﺸﺎﻫﺪه ﺷﺪ ﮐﻪ ﭘﺲ از ﭘﯿﻮﻧﺪ ﻣﺪﻓﻮع ﺑﻪ ﻣﻮش روﻧﺪ اﻓﺰاﯾﺶ وزن در ﻣﻮشﻫﺎﯾﯽ ﮐﻪ ﻧﻤﻮﻧﻪ ﻣﺪﻓﻮع ﺣﯿﻦ ﺟﺖ ﻟﮓ ﺑﻪ آنﻫﺎ ﭘﯿﻮﻧﺪ زده ﺷﺪه ﺑﻮد ﺑﻪ ﺷﮑﻞ ﻣﻌﻨﺎداری ﻧﺴﺒﺖ ﺑﻪ دو ﮔﺮوه دﯾﮕﺮ ﺑﯿﺸﺘﺮ ﺑﻮد. ﻫﻤﯿﻨﻄﻮر در اﯾﻦ ﺗﺤﻘﯿﻖ ﻣﺸﺎﻫﺪه ﺷﺪ ﮐﻪ ﭘﺲ از ﻣﺼﺮف ﮔﻠﻮﮐﺰ ﺧﻮراﮐﯽ، ﻣﯿﺰان ﮔﻠﻮﮐﺰ ﺧﻮن در ﻣﻮشﻫﺎی germ-free ﮐﻠﻮﻧﯿﺰه ﺷﺪه [20] ﺑﺎ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی ﻧﻤﻮﻧﻪ ﻣﺪﻓﻮع ﺣﯿﻦ ﺟﺖ-ﻟﮓ ﺑﻪ ﻃﺮز ﻣﻌﻨﺎداری ﺑﯿﺸﺘﺮ از ﮔﺮوه ﮐﻠﻮﻧﯿﺰه ﺷﺪه ﺑﺎ ﻧﻤﻮﻧﻪ ﭘﯿﺶ از ﺟﺖ-ﻟﮓ ﺑﻮده ﮐﻪ در ﮔﺮوه درﯾﺎﻓﺖ ﮐﻨﻨﺪه ﭘﺲ از رﯾﮑﺎوری اﯾﻦ ﺗﻐﯿﯿﺮ ﻣﺘﺎﺑﻮﻟﯿﮑﯽ ﻣﺸﺎﻫﺪه ﻧﺸﺪ.
از ﺳﻮی دﯾﮕﺮ ﺗﺤﻘﯿﻘﺎت ﻧﺸﺎن ﻣﯽدﻫﺪ ﮐﻪ ﺧﻮاب ﻧﺎﮐﺎﻓﯽ ﺑﺎ اﺿﺎﻓﻪ وزن و ﭼﺎﻗﯽ ﻣﺮﺗﺒﻂ اﺳﺖ. ﻣﻄﺎﻟﻌﺎت ﺑﻪ ﻃﻮر ﻣﺪاوم ﻧﺸﺎن ﻣﯽدﻫﻨﺪ ﮐﻪ ﺧﻮاب ﮐﻮﺗﺎه ﺑﺎ ﭼﺎﻗﯽ، دﯾﺎﺑﺖ ﻧﻮع ۲ و ﺳﻨﺪرم ﻣﺘﺎﺑﻮﻟﯿﮏ (ﮔﺮوﻫﯽ از ﺷﺮاﯾﻂ ﮐﻪ ﺧﻄﺮ ﺑﯿﻤﺎری ﻗﻠﺒﯽ، ﺳﮑﺘﻪ ﻣﻐﺰی و دﯾﺎﺑﺖ را اﻓﺰاﯾﺶ ﻣﯽدﻫﻨﺪ) ﻣﺮﺗﺒﻂ اﺳﺖ.
آزﻣﺎﯾﺶﻫﺎﯾﯽ ﮐﻪ در آن اﻓﺮاد ﺑﻪ ﻣﺪت ۲۴ ﺗﺎ ۱۲۰ ﺳﺎﻋﺖ ﺑﯿﺪار ﻧﮕﻪ داﺷﺘﻪ ﻣﯽﺷﻮﻧﺪ، ﺗﻐﯿﯿﺮاﺗﯽ در ﻋﻤﻠﮑﺮدﻫﺎی ﺑﺪن ﻣﺮﺗﺒﻂ ﺑﺎ ﺑﯿﻤﺎریﻫﺎی ﻣﺘﺎﺑﻮﻟﯿﮑﯽ را ﻧﺸﺎن ﻣﯽدﻫﻨﺪ. ﻫﻢ ﻣﺤﺪود ﮐﺮدن ﻣﯿﺰان ﺧﻮاب و ﻫﻢ اﺧﺘﻼل در اﻟﮕﻮﻫﺎی ﺧﻮاب و ﻫﻤﭽﻨﯿﻦ ﻧﺎﻫﻤﺎﻫﻨﮕﯽ ﺷﺒﺎﻧﻪروزی (ﻫﻨﮕﺎﻣﯽ ﮐﻪ ﺳﺎﻋﺖ داﺧﻠﯽ ﺷﻤﺎ از ﻫﻤﺎﻫﻨﮕﯽ ﺧﺎرج ﻣﯽﺷﻮد) ﺑﺮ ﻣﺘﺎﺑﻮﻟﯿﺴﻢ ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارد.
اﯾﻦ ﺗﻐﯿﯿﺮات اﯾﺠﺎد ﺷﺪه در وﺿﻌﯿﺖ ﺧﻮاب ﻧﻮﻋﯽ اﺳﺘﺮس ﻓﯿﺰﯾﻮﻟﻮژﯾﮏ ﺑﻪ ﺣﺴﺎب ﻣﯽآﯾﻨﺪ ﮐﻪ ﻣﻤﮑﻦ اﺳﺖ ﻣﺎﻧﻨﺪ اﺳﺘﺮس رواﻧﺸﻨﺎﺧﺘﯽ ﻣﻨﺠﺮ ﺑﻪ ﻓﻌﺎل ﺷﺪن ﭘﺎﺳﺦ اﺳﺘﺮس در ﺑﺪن ﺷﺪه و ﺑﺮ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده ﺗﺄﺛﯿﺮ ﺑﮕﺬارد و ﻋﻼوه ﺑﺮ ﺗﻐﯿﯿﺮ در ﺗﺮﮐﯿﺐ و ﺗﻨﻮع ﺑﺎﮐﺘﺮﯾﺎﯾﯽ (دﯾﺴﺒﯿﻮﺳﯿﺲ) ﻣﻨﺠﺮ ﺑﻪ اﻟﺘﻬﺎب و ﺑﻪ دﻧﺒﺎل آن آﺳﯿﺐ ﺑﻪ ﺳﺪ روده ای [21] ﺷﺪه و ﺑﺎ اﻓﺰاﯾﺶ ﻧﻔﻮذﭘﺬﯾﺮی روده ﺷﺮاﯾﻂ را ﺑﺮای اﯾﺠﺎد اﻟﺘﻬﺎب ﺳﯿﺴﺘﻤﯽ و ﮔﺴﺘﺮده و ﺣﺘﯽ ﺟﺎﺟﺎﯾﯽ ﺑﺎﮐﺘﺮیﻫﺎی ﻣﻀﺮ ﺑﻪ ﻧﻮاﺣﯽ دﯾﮕﺮ ﻓﺮاﻫﻢ ﮐﻨﺪ. ﻫﻤﻪ اﯾﻦ ﻣﻮارد ذﮐﺮ ﺷﺪه ﻣﯽﺗﻮاﻧﺪ ﻣﻨﺠﺮ ﺑﻪ ﺑﺮوز ﻣﺸﮑﻼت ﻣﺘﺎﺑﻮﻟﯿﮑﯽ ﺷﻮد. ﺑﻨﺎﺑﺮاﯾﻦ اﯾﻦ ﻣﺴﯿﺮ ﻣﻤﮑﻦ اﺳﺖ ﺗﻮﺿﯿﺢ دﻫﺪ ﮐﻪ ﭼﺮا و ﭼﮕﻮﻧﻪ ﺗﻐﯿﯿﺮ ﺷﯿﻔﺖ ﮐﺎری و ﺧﻮاب ﺿﻌﯿﻒ ﺑﺎ ﭼﺎﻗﯽ و ﻣﺸﮑﻼت ﻣﺮﺗﺒﻂ ﺑﺎ ﻣﺘﺎﺑﻮﻟﯿﮏ ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ.
در ﺗﺤﻘﯿﻘﯽ دﯾﮕﺮ در ﺳﺎل ۲۰۲۱ ﻣﺤﻘﻘﺎن درﯾﺎﻓﺘﻨﺪ ﮐﻪ ﻣﺤﺮوﻣﯿﺖ از ﺧﻮاب [22] ﻣﯽﺗﻮاﻧﺪ ﺑﺎﻋﺚ دﯾﺴﺒﯿﻮﺳﯿﺲ ﮔﺮدد. در اﯾﻦ ﭘﮋوﻫﺶ ﻣﺸﺎﻫﺪه ﺷﺪ ﮐﻪ ﻋﻠﯿﺮﻏﻢ ﻋﺪم ﻣﺸﺎﻫﺪه ﺗﻐﯿﯿﺮ در ﺗﺮﮐﯿﺐ ﻣﯿﮑﺮوﺑﯽ دﺳﺘﮕﺎه ﮔﻮارش ﭘﺲ از ۲۴ ﺳﺎﻋﺖ ﻣﺤﺮوﻣﯿﺖ از ﺧﻮاب، در ﺻﻮرت اداﻣﻪ روﻧﺪ ﻣﺤﺮوﻣﯿﺖ ﺗﺎ ۴۸ ﺳﺎﻋﺖ، اﯾﻦ وﺿﻌﯿﺖ ﻣﻨﺠﺮ ﺑﻪ ﺗﻐﯿﯿﺮات ﻣﺤﺴﻮﺳﯽ در ﺗﻨﻮع ﺑﺎﮐﺘﺮﯾﺎﯾﯽ روده ﺷﺪه و ﺷﺎﻫﺪ ﮐﺎﻫﺶ ﺗﻌﺪاد ﺑﺮﺧﯽ از ﺑﺎﮐﺘﺮیﻫﺎ ﻣﺎﻧﻨﺪ ﺑﻮﺗﯿﺮﯾﮑﻮﮐﻮس ﺑﻮﺗﯿﺮﯾﮑﯿﻤﻮﻧﺎس، آﻟﯿﺴﺘﯿﭙﺲ، اﯾﻨﺘﺴﺘﯿﻨﯿﻤﻮﻧﺎس و ﻻﮐﺘﻮﺑﺎﺳﯿﻠﻮس و اﻓﺰاﯾﺶ ﺗﻌﺪاد ﺑﺎﮐﺘﺮی اﺳﺘﺮﭘﺘﻮﮐﻮﮐﻮس ﻫﺴﺘﯿﻢ ﮐﻪ ﭘﺲ از دو ﻫﻔﺘﻪ رﯾﮑﺎوری ﺑﻪ ﺣﺎﻟﺖ ﻗﺒﻞ ﺑﺎز ﻣﯽﮔﺮدد. واﻧﮓ و ﻫﻤﮑﺎران در ﭘﮋوﻫﺶ دﯾﮕﺮی در ﺳﺎل ۲۰۲۳ ﻧﺸﺎن دادﻧﺪ ﮐﻪ ﺗﺄﺛﯿﺮات ﻣﺤﺎﻓﻈﺘﯽ و ﺑﻬﺒﻮد دﻫﻨﺪه ﻣﻼﺗﻮﻧﯿﻦ ﺑﺮ روی ﺣﺎﻓﻈﻪ، اﻟﺘﻬﺎب و ﺑﺎﻓﺖ ﻋﺼﺒﯽ در ﻣﺪل ﻣﺤﺮوﻣﯿﺖ از ﺧﻮاب ﻣﯽﺗﻮاﻧﺪ ﺑﻪ وﺳﯿﻠﻪ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده واﺳﻄﻪﮔﺮی ﺷﻮد. اﯾﻦ ﯾﺎﻓﺘﻪﻫﺎ ﻣﻨﻄﺒﻖ ﺑﺮ ﯾﺎﻓﺘﻪﻫﺎی ﺣﺎﺻﻞ از ﻣﻄﺎﻟﻌﻪ ﻣﺤﺮوﻣﯿﺖ ﺧﻮاب ﻣﯽﺑﺎﺷﻨﺪ ﮐﻪ اﺧﺘﻼل در ﯾﺎدﮔﯿﺮ و ﺣﺎﻓﻈﻪ، اﻟﺘﻬﺎب و ﺗﻐﯿﯿﺮات ﺧﻠﻖ و ﺧﻮ را ﻧﺸﺎن ﻣﯽدﻫﻨﺪ و ﺑﻪ ﻧﻮﻋﯽ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده را ﺑﻪ ﻋﻨﻮان ﯾﮏ واﺳﻄﻪ ﻣﻬﻢ در اﯾﺠﺎد اﯾﻦ ﺷﺮاﯾﻂ ﻣﻌﺮﻓﯽ ﻣﯽﮐﻨﻨﺪ. ﺑﻨﺎﺑﺮاﯾﻦ ﻃﺒﻖ ﺷﻮاﻫﺪ و اﺳﺘﺪﻻلﻫﺎ ﻣﯽﺗﻮان اﻧﺘﻈﺎر داﺷﺖ ﮐﻪ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده ﻣﯽﺗﻮاﻧﺪ ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻫﺪف ﻣﻬﻢ در ﻣﻄﺎﻟﻌﻪ ﻣﮑﺎﻧﯿﺴﻢﻫﺎی ﻣﺮﺗﺒﻂ ﺑﺎ ﺧﻮاب و ﺑﯿﻤﺎریﻫﺎی ﻣﺮﺗﺒﻂ ﺑﺎ آن ﺗﻠﻘﯽ ﮔﺮدد و ﻫﻤﭽﻨﯿﻦ ﺗﻐﯿﯿﺮی در ﭼﺎرﭼﻮبﻫﺎی ﻧﻈﺮی ﻣﺘﻤﺮﮐﺰ ﺑﺮ اﺳﺘﺮاﺗﮋیﻫﺎی درﻣﺎﻧﯽ اﯾﺠﺎد ﮐﻨﺪ. از اﯾﻦ رو ﺗﺤﻘﯿﻘﺎﺗﯽ ﻧﯿﺰ در ﺟﻬﺖ ﺑﺮرﺳﯽ ﭘﺘﺎﻧﺴﻞ ﻣﺪاﺧﻼت درﻣﺎﻧﯽ ﻣﺘﻤﺮﮐﺰ ﺑﺮ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎ ﺑﺮای درﻣﺎن اﺧﺘﻼﻻت ﻣﺮﺗﺒﻂ ﺑﺎ ﺧﻮاب اﻧﺠﺎم ﺷﺪه اﺳﺖ. دﯾﺪه ﺷﺪه ﮐﻪ ﻣﺼﺮف ﭘﺮوﺑﯿﻮﺗﯿﮏﻫﺎﯾﯽ ﻧﻈﯿﺮ ﻻﮐﺘﻮﺑﺎﺳﯿﻠﻮسﻫﺎ و ﺑﯿﻔﯿﺪوﺑﺎﮐﺘﺮﯾﻮم ﺑﺎ ﺟﻠﻮﮔﯿﺮی از رﺷﺪ ﺑﺎﮐﺘﺮیﻫﺎی ﻣﻀﺮ ﻧﻈﯿﺮ اﻧﺘﺮوﺑﺎﮐﺘﺮﯾﺎﺳﻪ، ﺗﻨﻈﯿﻢ ﺗﻌﺎدل ﻣﯿﮑﺮوﺑﯽ روده و ﻣﻬﺎر ﭘﺎﺳﺦ اﻟﺘﻬﺎﺑﯽ ﺑﺎﻋﺚ ﮐﺎﻫﺶ اﺳﺘﺮس و ﺑﻬﺒﻮد ﮐﯿﻔﯿﺖ ﺧﻮاب ﺷﺪه اﺳﺖ.
ﻫﻤﭽﻨﯿﻦ ﺗﺠﻮﯾﺰ ﮔﺎﻻﮐﺘﻮ اوﻟﯿﮕﻮﺳﺎﮐﺎرﯾﺪ و ﻓﺮوﮐﺘﻮ اوﻟﯿﮕﻮﺳﺎﮐﺎرﯾﺪ ﺑﻪ ﻋﻨﻮان ﭘﺮیﺑﯿﻮﺗﯿﮏ در ﻣﻮشﻫﺎی ﻣﺪل ﻣﺤﺮوﻣﯿﺖ از ﺧﻮاب ﺗﻮاﻧﺴﺘﻪ اﺳﺖ ﺑﺎ ﺗﻨﻈﯿﻢ اﻟﺘﻬﺎب و ﻫﻤﮕﺎمﺳﺎزی رﯾﺘﻢ ﺷﺒﺎﻧﻪ-روزی ﻋﻼﺋﻢ ﺷﺒﻪ اﺿﻄﺮاﺑﯽ را در ﻣﻮشﻫﺎ ﮐﺎﻫﺶ داده و اﻟﺘﻬﺎب ﻧﺎﺷﯽ از ﻣﺤﺮوﻣﯿﺖ از ﺧﻮاب را ﻧﯿﺰ ﮐﺎﻫﺶ دﻫﺪ.
ﻫﻤﭽﻨﯿﻦ در ﻧﻤﻮﻧﻪﻫﺎی اﻧﺴﺎﻧﯽ ﻣﺒﺘﻼ ﺑﻪ ﺑﯽﺧﻮاﺑﯽ دﯾﺪه ﺷﺪه ﮐﻪ ﭘﯿﻮﻧﺪ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی ﻣﺪﻓﻮع ﺑﺎﻋﺚ اﻓﺰاﯾﺶ ﻻﮐﺘﻮﺑﺎﺳﯿﻠﻮس و ﺑﯿﻔﯿﺪوﺑﺎﮐﺘﺮﯾﻮمﻫﺎ ﺷﺪه و ﺗﻌﺎدل ﺑﺮﻫﻢ ﺧﻮرده در ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی اﯾﻦ ﺑﯿﻤﺎران را ﺑﺎزﺗﻨﻈﯿﻢ ﻣﯽﮐﻨﺪ. ﺑﺪﯾﻦ ﺗﺮﺗﯿﺐ ﻣﻄﺎﻟﻌﺎت اﺧﯿﺮ ﭘﻨﺠﺮهای ﻧﻮ ﺑﻪ ﺳﻤﺖ ﺧﻮاب و اﺧﺘﻼﻻت ﻣﺮﺗﺒﻂ ﺑﺎ آن ﮔﺸﻮده اﺳﺖ ﮐﻪ ﻣﯽﺗﻮاﻧﺪ ﯾﺎری دﻫﻨﺪه ﻣﺎ در ﺑﻬﺒﻮد ﮐﯿﻔﯿﺖ ﯾﮑﯽ از ﻣﻬﻤﺘﺮﯾﻦ ﻓﺮاﯾﻨﺪﻫﺎی ﻓﯿﺰﯾﻮﻟﻮژﯾﮏ ﺑﺎﺷﺪ ﮐﻪ اﺧﺘﻼﻻت ﻣﺮﺗﺒﻂ ﺑﺎ آن ﺑﻨﺎ ﺑﻪ آﻣﺎر ﺑﺎزاری ﺑﻪ ارزش ۲۰ ﻣﯿﻠﯿﺎرد دﻻر را ﺑﻪ ﺧﻮد اﺧﺘﺼﺎص داده اﺳﺖ و در دﻫﻪ اﺧﯿﺮ رو ﺑﻪ ﻓﺰوﻧﯽ داﺷﺘﻪ اﺳﺖ. ﻫﺪف ﻗﺮار دادن ﻣﯿﮑﺮوﺑﯿﻮﺗﺎ در درﻣﺎن اﺧﺘﻼﻻت ﺧﻮاب و ﺑﺮرﺳﯽ اﺛﺮ ﻣﯿﮑﺮوﺑﯿﻮﺗﺎی روده در ﭘﺎﺗﻮﻓﯿﺰﯾﻮﻟﻮژی اﯾﻦ اﺧﺘﻼﻻت ﻧﻈﯿﺮ ﻧﺎرﮐﻮﻟﭙﺴﯽ و آﭘﻨﻪ ﺧﻮاب، زﻣﯿﻨﻪای ﻧﻮ ﻇﻬﻮر اﺳﺖ ﮐﻪ ﺑﻪ ﺗﺪاوم ﺗﺤﻘﯿﻘﺎت ﺑﺮای ﮔﺴﺘﺮش درک ﻣﺎ از اﯾﻦ ارﺗﺒﺎط ﺷﮕﻔﺖ اﻧﮕﯿﺰ ﻧﯿﺎز ﻣﺒﺮم دارد.
Footnote:
1. Neurodegenerative
2. Oxidative Stress
3. Neuroendocrine
4. Circadian Rhythm
5. Slow Wave Sleep
6. Rapid Eye Movement
7. Feedback Loop
8. Central
9. Peripheral
10. Delayed Sleep Phase Disorder
11. Clostridial
12. Lactobacilli
13. Parabacteroides
14. Roseburia
15. Enterobacter aerogenes
16. Mucispirillum schaedleri
17. Trimethylamine N-Oxide
18. Jet-Lag
19. Firmicutes
20. Colonized
21. Intestinal Barrier
22. Sleep Deprivation
منابع:
1. Brand, S., & Kirov, R. (2011). Sleep and its importance in adolescence and in common adolescent somatic and psychiatric conditions. International journal of general medicine, 425-442.
2. Worley, S. L. (2018). The extraordinary importance of sleep: the detrimental effects of inadequate sleep on health and public safety drive an explosion of sleep research. Pharmacy and Therapeutics, 43(12), 758.
3.Matenchuk, B. A., Mandhane, P. J., & Kozyrskyj, A. L. (2020). Sleep, circadian rhythm, and gut microbiota. Sleep Medicine Reviews, 53, 101340.
4. Soni, S. K., Basu, P., Singaravel, M., Sharma, R., Pandi- Perumal, S. R., Cardinali, D. P., & Reiter, R. J. (2021). Sirtuins and the circadian clock interplay in cardioprotection: focus on sirtuin 1. Cellular and Molecular Life Sciences, 78, 2503-2515.
5. Reynolds, A. C., Paterson, J. L., Ferguson, S. A., Stanley, D., Wright Jr, K. P., & Dawson, D. (2017). The shift work and health research agenda: considering changes in gut microbiota as a pathway linking shift work, sleep loss and circadian misalignment, and metabolic disease. Sleep medicine reviews, 34, 3-9.
6. Bishehsari, F., Voigt, R. M., & Keshavarzian, A. (2020). Circadian rhythms and the gut microbiota: from the metabolic syndrome to cancer. Nature Reviews Endocrinology, 16(12), 731-739.
7. Teichman, E. M., O’Riordan, K. J., Gahan, C. G., Dinan, T. G., & Cryan, J. F. (2020). When rhythms meet the blues: circadian interactions with the microbiota-gut- brain axis. Cell metabolism, 31(3), 448-471.
8. Thaiss, C. A., Zeevi, D., Levy, M., Zilberman-Schapira, G., Suez, J., Tengeler, A. C., ... & Elinav, E. (2014). Transkingdom control of microbiota diurnal oscillations promotes metabolic homeostasis. Cell, 159(3), 514-529.
9. Wang, Z., Yuan, K., Ji, Y. B., Li, S. X., Shi, L., Wang, Z., ... & Chen, W. H. (2022). Alterations of the gut microbiota in response to total sleep deprivation and recovery sleep in rats. Nature and Science of Sleep, 121- 133.
10. Wright, C. J., Milosavljevic, S., & Pocivavsek, A. (2023). The stress of losing sleep: Sex-specific neurobiological outcomes. Neurobiology of stress, 24, 100543.
11. Wang, X., Wang, Z., Cao, J., Dong, Y., & Chen, Y. (2023). Gut microbiota-derived metabolites mediate the neuroprotective effect of melatonin in cognitive impairment induced by sleep deprivation. Microbiome, 11(1), 17.
12. Lin, Z., Jiang, T., Chen, M., Ji, X., & Wang, Y. (2024). Gut microbiota and sleep: Interaction mechanisms and therapeutic prospects. Open Life Sciences, 19(1), 20220910.
گردآورنده: اردشیر نبی زاده
دانشگاه علوم پزشکی شهید بهشتی

