نگاهی کوتاه به رابطه آلزایمر و سندرم متابولیک
یک بیماری مغزی تحلیل برندۀ عصبی وابسته به سن است که غیرقابل برگشت بوده و به تدریج حافظه و مهارت های(AD) بیماری آلزایمر شناختی را تخریب می کند. از مشخصه های پاتولوژیک اصلی بیماری می توان به تجمع غیرطبیعی پروتئین های آمیلوئید بتا در خارج سلول های عصبی )پلاک های آمیلوئید بتا(، پروتئین های تائو هایپر فسفریله در داخل سلول های عصبی )کلافه های نوروفیبریلاری( و مرگ نورون ها اشاره داشت. در طول دهه های گذشته با وجود تلاش های بسیاری که برای پی بردن به پاتوژنز بیماری آلزایمر شده است هنوز درمان موثری برای غلبه بر بیماری وجود ندارد. می توان علت ناکارآمدی درمان های کنونی را پاتوژنز پیچیده ی بیماری آلزایمر دانست که به صورت چند جانبه است و ناشی از تعامل عوامل ژنتیکی و محیطی می باشد. سندرم متابولیک که تحت عنوان سندرم مقاومت به انسولین هم شناخته می شود، به عنوان یکی از ریسک فاکتورهای محیطی مهم AD معرفی شده است. (1)
سندرم متابولیک به مجموعه ای از شرایط مانند فشار خون بالا، سطوح افزایش یافته ی قند خون، چربی انباشته ی اضافی در اطراف شکم و سطوح افزایش یافته ی چربی خون و چاقی شکمی گفته می شود که با هم رخ می دهند و خطر ابتلا به بیماری های قلبی و دیابت نوع دوم را افزایش می دهند. شواهد تجربی و اپیدمیولوژیک فراوانی نشان می دهند که مقاومت به انسولین و دیابت نوع دوم، همبستگی مثبتی با ایجاد و پیشرفت الزایمر دارند (۲) و مدل های موشAD علاوه بر این، در مغز افراد مبتلا به اختلال در متابولیسم گلوکز، نقص در مسیر، AD سیگنالینگ انسولین، تغییر در سطح انسولین و کاهش پاسخ دهی به انسولین مشاهده شده است، به طوری که به بیماری آلزایمر، دیابت نوع سوم گفته می شود (3).
امروزه مشخص شده است که انسولین در مغز عملکردهای زیادی از جمله تنظیم تمایز نورون ها، رشد نوریت ها، متابولیسم انرژی، حفاظت از نورون ها در برابر استرس اکسیداتیو و تنظیم پلاستیسیتی سیناپسی را دارد (4). مطالعات نشان دادند که مهار سیگنالینگ انسولین در مغز با اختلالات حافظه، هایپرفسفریلاسیون نابجا پروتئین تائو و تجمع آمیلوئید بتا همراه شده است. ارتباط پیچیده و دوطرفه ای بین مقاومت به انسولین محیطی و مرکزی و مشاهده شده است . AD درگیری آن ها با ایجاد و پیشرفت مقاومت به انسولین محیطی با کاهش سطح انسولین مغز، کاهش گیرنده های انسولین مغز، مقاومت به انسولین مغز، التهاب عصبی، اختلال عملکرد میتوکندری، کاهش متابولیسم گلوکز مغز و تولید آمیلوئید بتا مرتبط شده است )۵(.
ارتباط بین آلزایمر و فشار خون بالا به علت بروز حوادث مغزی-عروقی پیشنهاد شده است. هایپرتانسیون به دلیل ایجاد تغییر در دیواره ی عروق باعث بروز هایپوتانسیون، ایسکمی و هایپوکسی مغزی و در نهایت منجر به تحریک پیشرفت آلزایمر می شود. با توجه به مطالعات، ایسکمی مغزی باعث پیشرفت تجمع آمیلوئید بتا و القای بیان می شود؛ پرسینیلین در تولید آمیلوئید presenilin)) پرسینیلین بتا شرکت می کند. همچنین هایپرتنسیون باعث از بین رفتن سد خونی-مغزی می شود که از ویژگی های پاتولوژیک آلزایمر محسوب می شود. طبق مطالعات اپیدمیولوژیکی ارتباط بین هایپرتانسیون و دمانس نیز به این صورت توضیح داده می شود که هایپرتانسیون در میانسالان باعث پیشرفت بیماری آلزایمر و بروز دمانس عروقی در ۱۵ تا ۲۰ سال آینده می شود (6). مطالعات قبلی نشان داده اند که بیماران آلزایمر نسبت به افراد معمول جامعه، ۱۰ درصد توتال کلسترول بیشتری دارند، که این یافته مطرح کننده ی کلسترول به عنوان یک ریسک فاکتور برای پیشرفت آلزایمر می باشد. افزایش کلسترول منجر به تخریب یکپارچگی سدخونی-مغزی می شود و به دنبال آن ریسک ابتلا به آلزایمر افزایش می یابد.

علاوه بر آن مطالعات مدل های حیوانی نشان داده اند که هایپرکلسترلمی منجر به افزایش رسوب پپتیدهای آمیلوئید بتا، هایپرفسفریلاسیون تائو، التهاب عصبی، اختلال شناختی، اختلال در عملکرد نورون های کولینرژیک و میکروهموراژی های مغزی می شود که در پاتولوژی های بیماری آلزایمر قرار می گیرد (7). همچنین، جدای از کلسترول سطح بالای اسیدهای چرب آزاد منجر به پیشرفت فرایندهای التهابی و در نتیجه بروز مقاومت به انسولین می شود. اگرچه ظرفیت اسیدهای چرب برای عبور از سد خونی-مغزی محدود می باشد، نشان داده اند که اسیدهای چرب توسط PET مطالعات بافت مغز نیز جذب می شوند. سندرم متابولیک باعث افزایش بازجذب و تجمع اسیدهای چرب در بافت مغزی می شود که کاهش وزن می تواند منجر به برگشت پاتوژنز شود. همچنین به طور گسترده ای مطالعات نشان داده اند که رژیم های غذایی پرچرب منجر به پیشرفت آلزایمر می شود و رژیم های اسیدهای چرب غیراشباع مانند دوکوزاهگزانوئیک اسید اثرات محافظت کننده ای را در مقابل آلزایمر نشان می دهند (8). ریسک دمانس به طور قابل توجهی در موارد چاقی افزایش می یابد، در واقع در مطالعات طولی که اندازه ی دور شکم افراد اندازه گیری شده است؛ نشان دادند که افزایش دور شکم به طور مستقیم با دمانس در ارتباط است. در مطالعه ای دیگر نشان داده شده است که در افرادی که نسبت دور کمر به لگن بیشتری دارند، حجم هیپوکمپ کمتری نیز دارند (9). ارتباط بین چاقی میانسالی و ریسک ابتلا به دمانس در افراد مسن توسط محققان زیادی مورد بررسی قرار گرفته است. برای مثال در مطالعه ی انجام شده توسط Xu et al افراد با اضافه وزن میانسالی BMI>25-30 و چاقی با ۳۰ BMI> احتمال بیشتری به دمانس مبتلا می شوند. مطالعه ی کوهورت دیگری نشان داده است که چاقی در میانسالی به طور قابل توجهی منجر به افزایش ریسک دمانس می شود درحالی که این ریسک زمانی که چاقی در دوران کهنسالی ایجاد شود کمتر می باشد.
رشد نورون ها، شکل پذیری سیناپسی و محافظت عصبی ایفا می کند. همچنین،IGF-1 در تنظیم متابولیسم گلوکز و سیگنال دهی انسولین نقش دارد. سطوح پایینIGF-1 با افزایش خطر ابتلا به بیماری آلزایمر مرتبط است. از سوی دیگر، CD44 یک پروتئین سطح سلولی است که در فرآیندهای سلولی مختلف از جمله چسبندگی و مهاجرت سلولی نقش دارد. CD44 التهاب و مقاومت به انسولین را که اجزای اصلی سندرم متابولیک هستند، افزایش می دهد. علاوه بر این، CD44 از طریق دخالت در تنظیم سیستم ایمنی در پاتوژنز بیماری آلزایمر نقش دارد. همچنین، FLT-1 که به عنوان گیرنده فاکتور رشد اندوتلیال عروقی شناخته می شود، در رگ زایی نقش دارد.FLT-1 در مقاومت به انسولین و فرآیندهای تخریب عصبی نیز نقش دارد. از سوی دیگرSPP1 در آلزایمر، به التهاب مزمن و فعال سازی سلول های میکروگلیا و آستروسایت ها کمک کرده و تجمع پلاک های آمیلوئیدی را تسریع می کند که منجر تخریب نورونی می شود. SPP1 در سندرم متابولیک، باعث التهاب مزمن، چاقی، مقاومت به انسولین و تشکیل پلاک های آترواسکلروتیک می شود. به طور کلی، SPP1 به عنوان یک مولکول التهابی کلیدی در هر دو بیماری عمل کرده و نقش مهمی در پیشرفت و شدت این شرایط دارد (14). همان طور که در شکل ۱ نقش رابط های مولکولی را در ایجاد بیماری آلزایمر و سندرم متابولیک نشان داده شده است؛ رابط های ملکولیSPP1, CD44, FLT-1, IGF-1 مسیرهای سیگنالیگ PI3k-Akt , HIF-1 , ECM-receptor را فعال کرده و از این طریق می توانند منجر به راه اندازی التهاب، مقاومت به انسولین و در نهایت بروز آلزایمر و سندرم متابولیک شود. به این ترتیب شناخت ملکول های ارتباط دهنده ی بیماری آلزایمر و سندرم متابولیک می تواند در تعیین اهداف درمانی نقش به سزایی داشته باشد. همچنین، این دانش می تواند به توسعه درمان های چند منظوره که به طور همزمان بتوانند بر علائم و پیشرفت هر دو بیماری تأثیر بگذارند و در نهایت کیفیت زندگی بیماران را بهبود بخشند، منجر شود.
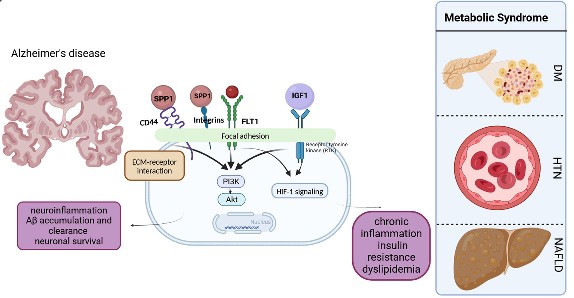
شکل 1 . ارتباط مولکولی سندرم متابولیک و بیماری آلزایمر
این شکل نشان می دهد که رابط های ملکولی از جمله SPP1, CD44, FLT-1, IGF-1 می توانند از طریق فعال کردن سیگنالینگ های داخل سلولی منجر به بروز التهاب، مقاومت به انسولین و اختلال در کلیرانس آمیلوئید بتا شوند به این ترتیب، به عنوان رابط های ملکولی آلزایمر و سندرم متابولیک شناخته می شوند.
نویسندگان:
مریم بذرگر
زهرا عزیزان
1. Anwal L. a Comprehensive Review on Alzheimer’S Disease. World J Pharm Pharm Sci. 2021;10(7):1170.
2. Mohamed SM, Shalaby MA, El-Shiekh RA, El-Banna HA, Emam SR, Bakr AF. Metabolic syndrome: risk factors, diagnosis, pathogenesis, and management with natural approaches. Food Chem Adv.2023;3(June).
3. Nguyen TT, Thanh Q, Ta H, Kim T, Nguyen O. Type 3 Diabetes and Its Role Implications in Alzheimer ’ s Disease. 2020;1–16.
4. Duarte AI, Moreira PI, Oliveira CR. Insulin in Central Nervous System : More than Just a Peripheral Hormone. 2012;2012.
5. Mullins RJ, Diehl TC, Chia CW, Kapogiannis D. Insulin Resistance as a Link between Amyloid-Beta and Tau Pathologies in Alzheimer ’ s Disease. 2017;9(May):1–16.
6. Feldstein CA. Association Between Chronic Blood Pressure Changes and Development of Alzheimer ’ s Disease HYPERTENSION AND INCIDENT. 2012;32:753–63.
7. Feringa FM, van der Kant R. Cholesterol and Alzheimer’s Disease; From Risk Genes to Pathological Effects. Front Aging Neurosci. 2021;13(June):1–17.
8. Xin Y, Wang Y, Chi J, Zhu X, Zhao H, Zhao S, et al. Elevated free fatty acid level is associated with insulinresistant state in nondiabetic Chinese people. Diabetes, Metab Syndr Obes. 2019;12:139–47.
9. Beydoun MA, Beydoun HA, Wang Y. Obesity and central obesity as risk factors for incident dementia and its subtypes: A systematic review and meta-analysis. Obes Rev. 2008;9(3):204–18.
10. Xu WL, Atti AR, Gatz M, Pedersen NL, Johansson B, Fratiglioni L. Midlife overweight and obesity increase latelife dementia risk: A population-based twin study. Neurology. 2011;76(18):1568–74.
11. Hamz R, Delangre E, Tolu S, Moreau M, Janel N, Bailb D, et al. Type 2 Diabetes Mellitus and Alzheimer ’ s Disease : Shared Molecular Mechanisms and Potential Common Therapeutic Targets. 2022;
12. Sciences M. A Pathophysiological Intersection of Diabetes and Alzheimer ’ s Disease. 2022;
13. Ezkurdia A, Ram J. Metabolic Syndrome as a Risk Factor for Alzheimer ’ s Disease : A Focus on Insulin Resistance. 2023;
14. Azizan Z, Id HZ, Mirmotalebisohi SA, Bazrgar M. Deciphering molecular bridges : Unveiling the interplay between metabolic syndrome and Alzheimer ’ s disease through a systems biology approach and drug repurposing. 2024;1–17. Available from: http://dx.doi.org/10.1371/journal.pone.0304410

