اتوفاژی: ﻣﮑﺎﻧﯿﺴﻢ ﺧﻮدﺗﺮﻣﯿﻤﯽ ﺳﻠﻮل در ﺑﺮاﺑﺮ ﭘﯿﺮی و ﺑﯿﻤﺎری
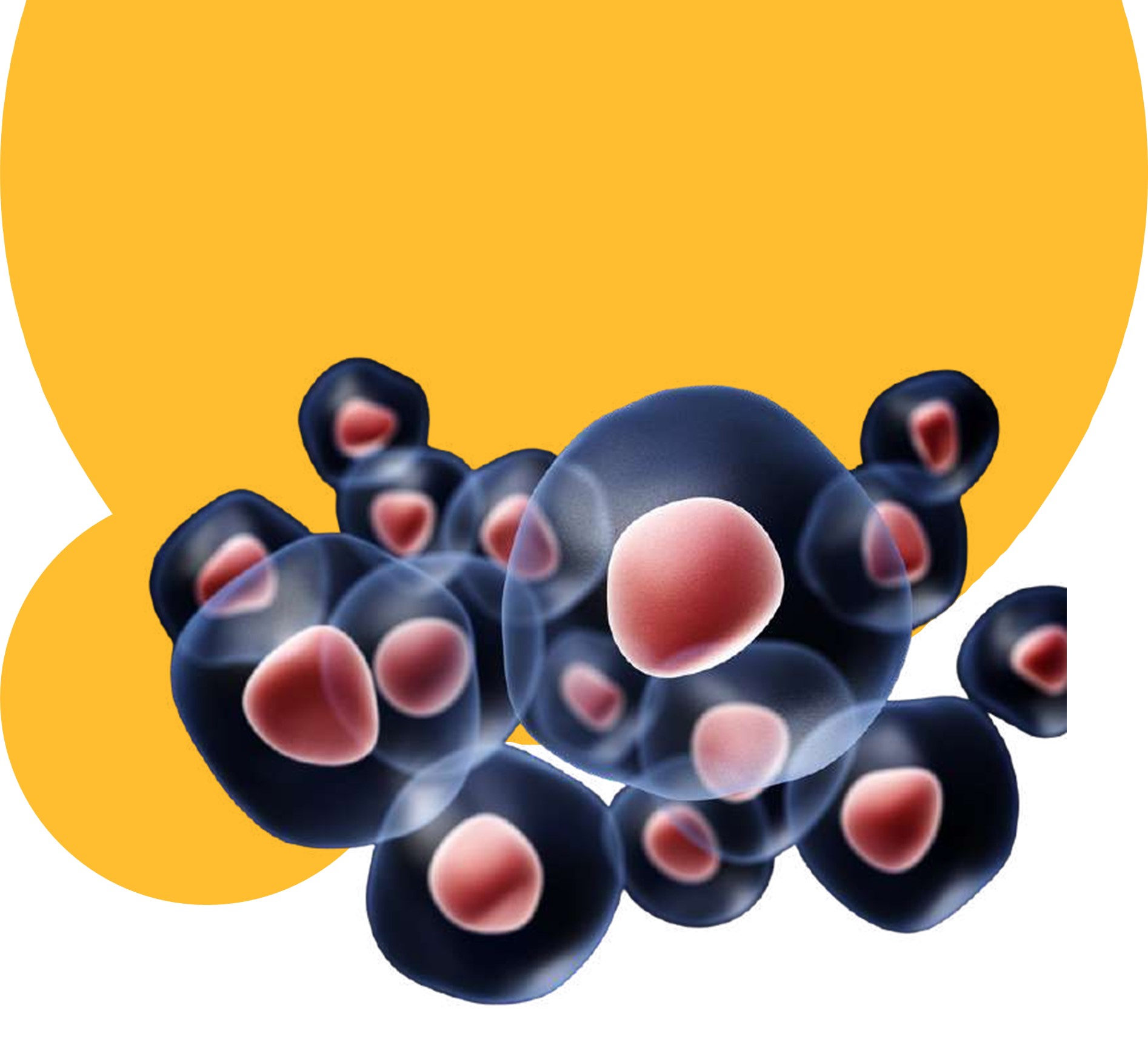
اﺗﻮﻓﺎژی در اﺻﻄﻼح ﻟﻐﻮی ﺑﻪ ﻣﻌﻨﺎی ﺧﻮدﺧﻮاری ﻣﯽ ﺑﺎﺷﺪ ﮐﻪ ﯾﮏ ﻣﮑﺎﻧﯿﺴﻢ ﺳﻠﻮﻟﯽ ﻫﻤﻮﺳﺘﺎﺗﯿﮏ ﺑﺴﯿﺎر ﺣﻔﺎﻇﺖ ﺷﺪه اﺳﺖ ﮐﻪ ﻣﻮﺟﺐ ﺗﺨﺮﯾﺐ اﻧﺪاﻣﮏﻫﺎی آﺳﯿﺐ دﯾﺪه، ﺗﺠﻤﻌﺎت ﭘﺮوﺗﺌﯿﻨﯽ ﺳﯿﺘﻮﭘﻼﺳﻤﯽ و ﭘﺎﺗﻮژن ﻫﺎی ﻣﻬﺎﺟﻢ از ﻃﺮﯾﻖ ﻣﺴﯿﺮ واﺑﺴﺘﻪ ﺑﻪ ﻟﯿﺰوزوم ﻣﯽ ﺷﻮد. ﻣﮑﺎﻧﯿﺴﻢ ﻓﻮق ﺑﺮای ﺣﻔﻆ ﻣﻨﺎﺑﻊ اﻧﺮژی ﺳﻠﻮﻟﯽ در ﭘﺎﺳﺦ ﺑﻪ اﺳﺘﺮس ﻣﻮاد ﻏﺬاﯾﯽ، رﺷﺪ ﺟﻨﯿﻦ و ﻋﻤﻠﮑﺮدﻫﺎی ﻣﺘﺎﺑﻮﻟﯿﮏ ﺳﻠﻮل دارای ﻧﻘﺶ ﮐﻠﯿﺪی ﻣﯽﺑﺎﺷﺪ. ﺗﺎﮐﻨﻮن ﺳﻪ ﻧﻮع اﺗﻮﻓﺎژی ﺑﺎ ﻧﺎمﻫﺎی ﻣﯿﮑﺮواﺗﻮﻓﺎژی، ﻣﺎﮐﺮواﺗﻮﻓﺎژی و اﺗﻮﻓﺎژی ﺑﺎ واﺳﻄﻪ ﭼﺎﭘﺮون ﻣﻌﺮﻓﯽ ﺷﺪه اﻧﺪ، اﻣﺎ ﺷﺎﯾﻌﺘﺮﯾﻦ ﻓﺮﻣﯽ ﮐﻪ در اﮐﺜﺮ ﻣﻄﺎﻟﻌﺎت ﻣﻮرد ﺑﺮرﺳﯽ ﻗﺮار ﮔﺮﻓﺘﻪ اﺳﺖ ﻣﺎﮐﺮواﺗﻮﻓﺎژی ﻣﯽ ﺑﺎﺷﺪ. درﮐﻨﺎر ﻋﻤﻠﮑﺮد در ﺳﺎزﮔﺎری ﺳﻠﻮل ﻫﺎ ﺑﺎ ﺷﺮاﯾﻂ ﻣﺘﻐﯿﺮ، اﺗﻮﻓﺎژی ﻧﻘﺶ ﺑﺮﺟﺴﺘﻪای در ﺗﻌﯿﯿﻦ ﻃﻮل ﻋﻤﺮ ﺑﺴﯿﺎری از ارﮔﺎﻧﯿﺴﻢﻫﺎ دارا ﻣﯽﺑﺎﺷﺪ. ﻣﻄﺎﻟﻌﺎت ﻧﺸﺎن داده اﻧﺪ، ﮐﺎﻫﺶ اﺗﻮﻓﺎژی ﺑﺎ ﺗﺴﺮﯾﻊ ﭘﯿﺮی ﻣﺮﺗﺒﻂ اﺳﺖ، در ﺣﺎﻟﯽ ﮐﻪ ﺗﺤﺮﯾﮏ اﺗﻮﻓﺎژی ﻣﻤﮑﻦ اﺳﺖ اﺛﺮات ﺿﺪ ﭘﯿﺮی ﻗﻮی از ﺧﻮد ﻧﺸﺎن دﻫﺪ. ﺑﻨﺎﺑﺮاﯾﻦ، ﻫﺪف ﻗﺮار دادن اﺗﻮﻓﺎژی در ﻃﻮل ﻓﺮآﯾﻨﺪ ﭘﯿﺮی ﻣﻤﮑﻦ اﺳﺖ ﺑﻪ ﻃﻮر ﻣﻮﺛﺮ از ﺷﺮوع اﺧﺘﻼﻻت ﻣﺮﺗﺒﻂ ﺑﺎ اﻓﺰاﯾﺶ ﺳﻦ ﺟﻠﻮﮔﯿﺮی ﮐﻨﺪ.
ﻣﺎﮐﺮواﺗﻮﻓﺎژی )ﮐﻪ از اﯾﻦ ﭘﺲ ﺑﻪ آن اﺗﻮﻓﺎژی ﮔﻔﺘﻪ ﻣﯽﺷﻮد( ﯾﮏ ﻓﺮآﯾﻨﺪ ﺳﻠﻮﻟﯽ اﺳﺎﺳﯽ اﺳﺖ ﮐﻪ ﻣﺴﺌﻮل ﺗﺠﺰﯾﻪ و ﺑﺎزﯾﺎﻓﺖ ﻣﺤﺘﻮای ﺳﯿﺘﻮﭘﻼﺳﻤﯽ ﻣﯽ ﺑﺎﺷﺪ. از زﻣﺎن ﮐﺸﻒ آن در دﻫﻪ ۱۹۶۰، اﺗﻮﻓﺎژی ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻋﺎﻣﻞ ﮐﻠﯿﺪی در ﺷﺮاﯾﻂ ﻓﯿﺰﯾﻮﻟﻮژﯾﮑﯽ و ﭘﺎﺗﻮﻟﻮژﯾﮑﯽ ﻣﺘﻌﺪد، از ﺟﻤﻠﻪ ﭘﯿﺮی و ﺑﯿﻤﺎریﻫﺎی ﻧﻮرودژﻧﺮاﺗﯿﻮ، ﺷﻨﺎﺧﺘﻪ ﺷﺪه اﺳﺖ.
ﺷﺮوع ﻓﺮآﯾﻨﺪ اﺗﻮﻓﺎژی ﺑﺎ ﺗﺸﮑﯿﻞ ﺳﺎﺧﺘﺎرﻫﺎی دوﻻﯾﻪای ﺑﻪ ﻧﺎم ﻓﺎﮔﻮﻓﻮر [1] آﻏﺎز ﻣﯽﺷﻮد. اﯾﻦ ﺳﺎﺧﺘﺎرﻫﺎی اﻧﮕﺸﺖ ﻣﺎﻧﻨﺪ از ﺑﺨﺶ اﻧﺪوزوم ﺑﺎزﯾﺎﻓﺘﯽ ﻣﺜﺒﺖ ﺑﺮای RAB11A ﺳﺮﭼﺸﻤﻪ ﻣﯽﮔﯿﺮﻧﺪ و وﻇﯿﻔﻪ ﺟﺬب و ﺑﻪ دام اﻧﺪاﺧﺘﻦ ﺳﻮﺑﺴﺘﺮاﻫﺎ )ﻣﻮاد ﺳﻠﻮﻟﯽ( را ﺑﺮ ﻋﻬﺪه دارﻧﺪ.
ﺟﺎﻟﺐ اﺳﺖ ﮐﻪ اﺧﺘﻼل در اﺗﻮﻓﺎژی ﻣﯽﺗﻮاﻧﺪ ﻣﻨﺠﺮ ﺑﻪ ﭘﯿﺮی ﺳﻠﻮﻟﯽ [2] ﺷﻮد. اﯾﻦ ﻓﺮاﯾﻨﺪ اﻣﮑﺎن ﮐﻨﺘﺮل ﮐﯿﻔﯿﺖ ﺳﻠﻮﻟﯽ و ﺳﺎزﮔﺎری ﻣﺘﺎﺑﻮﻟﯿﮏ ﺑﺎ اﺳﺘﺮس را ﻓﺮاﻫﻢ ﻣﯽﮐﻨﺪ، ﺑﺴﯿﺎری از ﻣﻄﺎﻟﻌﺎت اﺗﻮﻓﺎژی را ﺑﻪﻋﻨﻮان ﻋﺎﻣﻞ ﻣﺮﮐﺰی در ﺗﻨﻈﯿﻢ ﻓﻨﻮﺗﯿﭗﻫﺎی ﭘﯿﺮی ﻗﺮار داده اﻧﺪ. اﯾﻦ ﻣﻮﺿﻮع اﻫﻤﯿﺖ اﺗﻮﻓﺎژی را در ﺣﻔﻆ ﺳﻼﻣﺖ ﺳﻠﻮﻟﯽ و ﮐﺎﻫﺶ اﺛﺮات ﭘﯿﺮی ﺑﺮﺟﺴﺘﻪ ﻣﯽﮐﻨﺪ. ﺑﺮ اﯾﻦ اﺳﺎس، ﭘﯿﺮی ﺑﺎ ﺗﻐﯿﯿﺮات ﭘﯿﭽﯿﺪه ای در ﻣﺴﯿﺮ اﺗﻮﻓﺎژی- ﻟﯿﺰوزوﻣﯽ ﻣﺮﺗﺒﻂ ﺷﺪه اﺳﺖ. اﯾﻦ ﺗﻐﯿﯿﺮات ﻧﺸﺎندﻫﻨﺪه ﺗﺄﺛﯿﺮ ﻋﻤﯿﻖ ﭘﯿﺮی ﺑﺮ ﺳﯿﺴﺘﻢﻫﺎی ﺳﻠﻮﻟﯽ و ﻧﻘﺶ ﮐﻠﯿﺪی اﺗﻮﻓﺎژی در ﺣﻔﻆ ﺳﻼﻣﺖ و ﻋﻤﻠﮑﺮد ﺳﻠﻮﻟﯽ اﺳﺖ.

اﺗﻮﻓﺎژی و ﺑﯿﻤﺎری اﻟﺰاﯾﻤﺮ:
ﻣﻄﺎﻟﻌﺎت ﻣﺘﻌﺪد ﻧﺸﺎن داده اﻧﺪ ﮐﻪ ﮐﻤﺒﻮد اﺗﻮﻓﺎژی در ﻣﺮاﺣﻞ اوﻟﯿﻪ ﺑﯿﻤﺎری آﻟﺰاﯾﻤﺮ رخ ﻣﯽدﻫﺪ. اﺗﻮﻓﺎژی ﻧﻘﺶ ﻣﻬﻤﯽ در ﺗﻮﻟﯿﺪ و ﻣﺘﺎﺑﻮﻟﯿﺴﻢ ﺑﺘﺎ آﻣﯿﻠﻮﺋﯿﺪ و ﺗﺠﻤﻊ ﺗﺎو اﯾﻔﺎ ﻣﯽﮐﻨﺪ. ﺑﻨﺎﺑﺮاﯾﻦ، اﺧﺘﻼل در ﻋﻤﻠﮑﺮد آن ﻣﻤﮑﻦ اﺳﺖ ﺑﻪ ﭘﯿﺸﺮﻓﺖ ﺑﯿﻤﺎری آﻟﺰاﯾﻤﺮ ﻣﻨﺠﺮ ﺷﻮد. ﺑﺎ ﺗﻮﺟﻪ ﺑﻪ ﺷﻮاﻫﺪ ﻓﻮق، اﺗﻮﻓﺎژی ﻣﯽﺗﻮاﻧﺪ ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻫﺪف ﺟﺪﯾﺪ در ﺗﻮﺳﻌﻪ داروﻫﺎی ﺑﯿﻤﺎری آﻟﺰاﯾﻤﺮ ﻣﻮرد ﺗﻮﺟﻪ ﻗﺮار ﮔﯿﺮد. ﺗﺎﮐﻨﻮن ﺗﻌﺪادی از ﺗﻨﻈﯿﻢﮐﻨﻨﺪهﻫﺎی اﺗﻮﻓﺎژی واﺑﺴﺘﻪ ﺑﻪ MTOR )ﻣﻮﻟﮑﻮلِ ﻫﺪفِ راﭘﺎﻣﺎﯾﺴﯿﻦ در ﭘﺴﺘﺎﻧﺪاران( و ﻣﺴﺘﻘﻞ از MTOR ﺷﻨﺎﺳﺎﯾﯽ ﺷﺪه اﻧﺪ ﮐﻪ اﺛﺮات ﻣﺜﺒﺘﯽ در درﻣﺎن ﺑﯿﻤﺎری آﻟﺰاﯾﻤﺮ داﺷﺘﻪاﻧﺪ.
اﺗﻮﻓﺎژی در اﺻﻄﻼح ﻟﻐﻮی ﺑﻪ ﻣﻌﻨﺎی ﺧﻮدﺧﻮاری ﻣﯽ ﺑﺎﺷﺪ ﮐﻪ ﯾﮏ ﻣﮑﺎﻧﯿﺴﻢ ﺳﻠﻮﻟﯽ ﻫﻤﻮﺳﺘﺎﺗﯿﮏ ﺑﺴﯿﺎر ﺣﻔﺎﻇﺖ ﺷﺪه اﺳﺖ ﮐﻪ ﻣﻮﺟﺐ ﺗﺨﺮﯾﺐ اﻧﺪاﻣﮏﻫﺎی آﺳﯿﺐ دﯾﺪه، ﺗﺠﻤﻌﺎت ﭘﺮوﺗﺌﯿﻨﯽ ﺳﯿﺘﻮﭘﻼﺳﻤﯽ و ﭘﺎﺗﻮژن ﻫﺎی ﻣﻬﺎﺟﻢ از ﻃﺮﯾﻖ ﻣﺴﯿﺮ واﺑﺴﺘﻪ ﺑﻪ ﻟﯿﺰوزوم ﻣﯽ ﺷﻮد. ﻣﮑﺎﻧﯿﺴﻢ ﻓﻮق ﺑﺮای ﺣﻔﻆ ﻣﻨﺎﺑﻊ اﻧﺮژی ﺳﻠﻮﻟﯽ در ﭘﺎﺳﺦ ﺑﻪ اﺳﺘﺮس ﻣﻮاد ﻏﺬاﯾﯽ، رﺷﺪ ﺟﻨﯿﻦ و ﻋﻤﻠﮑﺮدﻫﺎی ﻣﺘﺎﺑﻮﻟﯿﮏ ﺳﻠﻮل دارای ﻧﻘﺶ ﮐﻠﯿﺪی ﻣﯽﺑﺎﺷﺪ. ﺗﺎﮐﻨﻮن ﺳﻪ ﻧﻮع اﺗﻮﻓﺎژی ﺑﺎ ﻧﺎمﻫﺎی ﻣﯿﮑﺮواﺗﻮﻓﺎژی، ﻣﺎﮐﺮواﺗﻮﻓﺎژی و اﺗﻮﻓﺎژی ﺑﺎ واﺳﻄﻪ ﭼﺎﭘﺮون ﻣﻌﺮﻓﯽ ﺷﺪه اﻧﺪ، اﻣﺎ ﺷﺎﯾﻌﺘﺮﯾﻦ ﻓﺮﻣﯽ ﮐﻪ در اﮐﺜﺮ ﻣﻄﺎﻟﻌﺎت ﻣﻮرد ﺑﺮرﺳﯽ ﻗﺮار ﮔﺮﻓﺘﻪ اﺳﺖ ﻣﺎﮐﺮواﺗﻮﻓﺎژی ﻣﯽ ﺑﺎﺷﺪ. درﮐﻨﺎر ﻋﻤﻠﮑﺮد در ﺳﺎزﮔﺎری ﺳﻠﻮل ﻫﺎ ﺑﺎ ﺷﺮاﯾﻂ ﻣﺘﻐﯿﺮ، اﺗﻮﻓﺎژی ﻧﻘﺶ ﺑﺮﺟﺴﺘﻪای در ﺗﻌﯿﯿﻦ ﻃﻮل ﻋﻤﺮ ﺑﺴﯿﺎری از ارﮔﺎﻧﯿﺴﻢﻫﺎ دارا ﻣﯽﺑﺎﺷﺪ. ﻣﻄﺎﻟﻌﺎت ﻧﺸﺎن داده اﻧﺪ، ﮐﺎﻫﺶ اﺗﻮﻓﺎژی ﺑﺎ ﺗﺴﺮﯾﻊ ﭘﯿﺮی ﻣﺮﺗﺒﻂ اﺳﺖ، در ﺣﺎﻟﯽ ﮐﻪ ﺗﺤﺮﯾﮏ اﺗﻮﻓﺎژی ﻣﻤﮑﻦ اﺳﺖ اﺛﺮات ﺿﺪ ﭘﯿﺮی ﻗﻮی از ﺧﻮد ﻧﺸﺎن دﻫﺪ. ﺑﻨﺎﺑﺮاﯾﻦ، ﻫﺪف ﻗﺮار دادن اﺗﻮﻓﺎژی در ﻃﻮل ﻓﺮآﯾﻨﺪ ﭘﯿﺮی ﻣﻤﮑﻦ اﺳﺖ ﺑﻪ ﻃﻮر ﻣﻮﺛﺮ از ﺷﺮوع اﺧﺘﻼﻻت ﻣﺮﺗﺒﻂ ﺑﺎ اﻓﺰاﯾﺶ ﺳﻦ ﺟﻠﻮﮔﯿﺮی ﮐﻨﺪ.
ﻣﺎﮐﺮواﺗﻮﻓﺎژی )ﮐﻪ از اﯾﻦ ﭘﺲ ﺑﻪ آن اﺗﻮﻓﺎژی ﮔﻔﺘﻪ ﻣﯽﺷﻮد( ﯾﮏ ﻓﺮآﯾﻨﺪ ﺳﻠﻮﻟﯽ اﺳﺎﺳﯽ اﺳﺖ ﮐﻪ ﻣﺴﺌﻮل ﺗﺠﺰﯾﻪ و ﺑﺎزﯾﺎﻓﺖ ﻣﺤﺘﻮای ﺳﯿﺘﻮﭘﻼﺳﻤﯽ ﻣﯽ ﺑﺎﺷﺪ. از زﻣﺎن ﮐﺸﻒ آن در دﻫﻪ ۱۹۶۰، اﺗﻮﻓﺎژی ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻋﺎﻣﻞ ﮐﻠﯿﺪی در ﺷﺮاﯾﻂ ﻓﯿﺰﯾﻮﻟﻮژﯾﮑﯽ و ﭘﺎﺗﻮﻟﻮژﯾﮑﯽ ﻣﺘﻌﺪد، از ﺟﻤﻠﻪ ﭘﯿﺮی و ﺑﯿﻤﺎریﻫﺎی ﻧﻮرودژﻧﺮاﺗﯿﻮ، ﺷﻨﺎﺧﺘﻪ ﺷﺪه اﺳﺖ.
ﺷﺮوع ﻓﺮآﯾﻨﺪ اﺗﻮﻓﺎژی ﺑﺎ ﺗﺸﮑﯿﻞ ﺳﺎﺧﺘﺎرﻫﺎی دوﻻﯾﻪای ﺑﻪ ﻧﺎم ﻓﺎﮔﻮﻓﻮر [1] آﻏﺎز ﻣﯽﺷﻮد. اﯾﻦ ﺳﺎﺧﺘﺎرﻫﺎی اﻧﮕﺸﺖﻣﺎﻧﻨﺪ از ﺑﺨﺶ اﻧﺪوزوم ﺑﺎزﯾﺎﻓﺘﯽ ﻣﺜﺒﺖ ﺑﺮای RAB11A ﺳﺮﭼﺸﻤﻪ ﻣﯽﮔﯿﺮﻧﺪ و وﻇﯿﻔﻪ ﺟﺬب و ﺑﻪ دام اﻧﺪاﺧﺘﻦ ﺳﻮﺑﺴﺘﺮاﻫﺎ )ﻣﻮاد ﺳﻠﻮﻟﯽ( را ﺑﺮ ﻋﻬﺪه دارﻧﺪ.
ﺟﺎﻟﺐ اﺳﺖ ﮐﻪ اﺧﺘﻼل در اﺗﻮﻓﺎژی ﻣﯽﺗﻮاﻧﺪ ﻣﻨﺠﺮ ﺑﻪ ﭘﯿﺮی ﺳﻠﻮﻟﯽ [2] ﺷﻮد. اﯾﻦ ﻓﺮاﯾﻨﺪ اﻣﮑﺎن ﮐﻨﺘﺮل ﮐﯿﻔﯿﺖ ﺳﻠﻮﻟﯽ و ﺳﺎزﮔﺎری ﻣﺘﺎﺑﻮﻟﯿﮏ ﺑﺎ اﺳﺘﺮس را ﻓﺮاﻫﻢ ﻣﯽﮐﻨﺪ، ﺑﺴﯿﺎری از ﻣﻄﺎﻟﻌﺎت اﺗﻮﻓﺎژی را ﺑﻪﻋﻨﻮان ﻋﺎﻣﻞ ﻣﺮﮐﺰی در ﺗﻨﻈﯿﻢ ﻓﻨﻮﺗﯿﭗﻫﺎی ﭘﯿﺮی ﻗﺮار داده اﻧﺪ. اﯾﻦ ﻣﻮﺿﻮع اﻫﻤﯿﺖ اﺗﻮﻓﺎژی را در ﺣﻔﻆ ﺳﻼﻣﺖ ﺳﻠﻮﻟﯽ و ﮐﺎﻫﺶ اﺛﺮات ﭘﯿﺮی ﺑﺮﺟﺴﺘﻪ ﻣﯽﮐﻨﺪ. ﺑﺮ اﯾﻦ اﺳﺎس، ﭘﯿﺮی ﺑﺎ ﺗﻐﯿﯿﺮات ﭘﯿﭽﯿﺪه ای در ﻣﺴﯿﺮ اﺗﻮﻓﺎژی- ﻟﯿﺰوزوﻣﯽ ﻣﺮﺗﺒﻂ ﺷﺪه اﺳﺖ. اﯾﻦ ﺗﻐﯿﯿﺮات ﻧﺸﺎندﻫﻨﺪه ﺗﺄﺛﯿﺮ ﻋﻤﯿﻖ ﭘﯿﺮی ﺑﺮ ﺳﯿﺴﺘﻢﻫﺎی ﺳﻠﻮﻟﯽ و ﻧﻘﺶ ﮐﻠﯿﺪی اﺗﻮﻓﺎژی در ﺣﻔﻆ ﺳﻼﻣﺖ و ﻋﻤﻠﮑﺮد ﺳﻠﻮﻟﯽ اﺳﺖ.
اﺗﻮﻓﺎژی و ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن:
اﺗﻮﻓﺎژی و ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن: ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن دوﻣﯿﻦ ﺑﯿﻤﺎری ﺷﺎﯾﻊ ﻧﻮرودژﻧﺮاﺗﯿﻮ اﺳﺖ ﮐﻪ ﺑﺎ اﺧﺘﻼل در ﺳﯿﺴﺘﻢ ﺣﺮﮐﺘﯽ ﻣﺸﺨﺺ ﻣﯽﺷﻮد. ﻋﻠﺖﺷﻨﺎﺳﯽ ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن ﺑﺎ ﭘﯿﺮی، ﺳﻤﻮم ﻣﺤﯿﻄﯽ و ﺟﻬﺶﻫﺎی ژﻧﺘﯿﮑﯽ ﻣﺮﺗﺒﻂ اﺳﺖ، در ﺣﺎﻟﯽ ﮐﻪ ﭘﺎﺗﻮژﻧﺰ ﻣﻮﻟﮑﻮﻟﯽ اﯾﻦ ﺑﯿﻤﺎری ﺷﺎﻣﻞ ﻋﻮاﻣﻞ ﻣﺨﺘﻠﻔﯽ ﻣﺎﻧﻨﺪ اﺧﺘﻼل در ﻫﻤﻮﺳﺘﺎز ﭘﺮوﺗﺌﯿﻨﯽ، اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ، اﺧﺘﻼل ﻋﻤﻠﮑﺮد ﻣﯿﺘﻮﮐﻨﺪری، اﺧﺘﻼل در اﻧﺘﻘﺎل ﺳﯿﻨﺎﭘﺴﯽ، ﻋﺪم ﺗﻌﺎدل در ﻫﻤﻮﺳﺘﺎز ﮐﻠﺴﯿﻢ، اﻧﺘﻘﺎل ﭘﺮﯾﻮن ﻣﺎﻧﻨﺪ آﻟﻔﺎ ﺳﯿﻨﻮﮐﻠﺌﯿﻦ و اﻟﺘﻬﺎب ﻧﻮروﻧﯽ ﻣﯽﺑﺎﺷﺪ. اﺗﻮﻓﺎژی ﯾﮏ ﻓﺮآﯾﻨﺪ ﺗﺨﺮﯾﺒﯽ ﺣﻔﺎﻇﺖﺷﺪه ﺑﺮای ﺣﻔﻆ ﻫﻤﻮﺳﺘﺎز ﺳﻠﻮﻟﯽ اﺳﺖ. اﺧﺘﻼل در اﺗﻮﻓﺎژی ﺑﻪ ﻋﻨﻮان ﯾﮑﯽ از ﻋﻮاﻣﻞ دﺧﯿﻞ در ﭘﺎﺗﻮژﻧﺰ ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن ﮔﺰارش ﺷﺪه اﺳﺖ. ﭘﺮوﺗﺌﯿﻦﻫﺎی ﮐﺪ ﺷﺪه ﺗﻮﺳﻂ ﭼﻨﺪﯾﻦ ژن ﻣﺮﺗﺒﻂ ﺑﺎ ﭘﺎرﮐﯿﻨﺴﻮن، ﻣﺎﻧﻨﺪ SNCA, VPS35, ATP13A2, GBA, LRRK2, FBXO7, در فرآیند اﺗﻮﻓﺎژی دﺧﯿﻞ ﻫﺴﺘﻨﺪ و ﯾﺎ ﺗﺤﺖ ﺗﺄﺛﯿﺮ آن ﻗﺮار ﻣﯽﮔﯿﺮﻧﺪ. ﻋﻼوه ﺑﺮ اﯾﻦ، روﯾﺪادﻫﺎی ﭘﺎﺗﻮژﻧﯿﮏ ﻣﺨﺘﻠﻒ در ﻃﻮل ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن ﺑﻪﻃﻮر ﻣﺴﺘﻘﯿﻢ ﯾﺎ ﻏﯿﺮﻣﺴﺘﻘﯿﻢ در ﻣﺴﯿﺮ اﺗﻮﻓﺎژی اﺧﺘﻼل اﯾﺠﺎد ﻣﯽﮐﻨﻨﺪ و ﺗﻨﻈﯿﻢ ﻧﺸﺪن اﺗﻮﻓﺎژی در ﻣﺪلﻫﺎی ﻧﻮروﺗﻮﮐﺴﯿﮏ ﻣﺨﺘﻠﻒ ﭘﺎرﮐﯿﻨﺴﻮن ﻣﺸﺎﻫﺪه ﺷﺪه اﺳﺖ.
اﺗﻮﻓﺎژی ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻫﺪف درﻣﺎﻧﯽ ﺑﺎﻟﻘﻮه ﺑﺮای درﻣﺎن ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﺷﺪه اﺳﺖ. در واﻗﻊ، ﺗﻨﻈﯿﻢ ﺑﯿﺎن ژنﻫﺎی ﻣﺮﺗﺒﻂ ﺑﺎ اﺗﻮﻓﺎژی ﻣﺎﻧﻨﺪ BECN1 و TFEB اﺛﺮات ﻣﺤﺎﻓﻈﺖﮐﻨﻨﺪه ﻋﺼﺒﯽ در ﻣﺪلﻫﺎی ﭘﺎرﮐﯿﻨﺴﻮن داﺷﺘﻪ اﺳﺖ، و ﺗﻨﻈﯿﻢﮐﻨﻨﺪهﻫﺎی ﻣﺨﺘﻠﻒ اﺗﻮﻓﺎژی، ﻣﺎﻧﻨﺪ رﭘﺎﻣﺎﯾﺴﯿﻦ، ﺗﺮﻫﺎﻟﻮز، ﺗﻌﺪﯾﻞﮐﻨﻨﺪهﻫﺎی ﻟﯿﺰوزوﻣﯽ و ﺳﺎﯾﺮ اﻟﻘﺎﮐﻨﻨﺪهﻫﺎی اﺗﻮﻓﺎژی در ﻣﻘﯿﺎس ﮐﻮﭼﮏ، اﺛﺮات ﻣﺤﺎﻓﻈﺖﮐﻨﻨﺪه ﻋﺼﺒﯽ در ﻣﺪلﻫﺎی ﺗﺠﺮﺑﯽ ﭘﺎرﮐﯿﻨﺴﻮن ﻧﺸﺎن داده اﻧﺪ. در ﻣﺠﻤﻮع، اﺧﺘﻼل در اﺗﻮﻓﺎژی در ﭘﺎﺗﻮژﻧﺰ ﺑﯿﻤﺎری ﭘﺎرﮐﯿﻨﺴﻮن ﻧﻘﺶ دارد و ﺗﻌﺪﯾﻞ ﻓﺎرﻣﺎﮐﻮﻟﻮژﯾﮏ اﺗﻮﻓﺎژی ﻣﻤﮑﻦ اﺳﺖ ﯾﮏ اﺳﺘﺮاﺗﮋی درﻣﺎﻧﯽ ﺟﺪﯾﺪ ﺑﺮای درﻣﺎن اﯾﻦ ﺑﯿﻤﺎری ﺑﺎﺷﺪ.
اﺗﻮﻓﺎژی و ﺑﯿﻤﺎری ALS:
اﺳﮑﻠﺮوز ﺟﺎﻧﺒﯽ آﻣﯿﻮﺗﺮوﻓﯿﮏ [1] (ALS) ﯾﮏ ﺑﯿﻤﺎری ﻧﻮرودژﻧﺮاﺗﯿﻮ ﺑﺎ ﺷﺮوع دﯾﺮﻫﻨﮕﺎم اﺳﺖ ﮐﻪ ﺑﺎ ﺗﺨﺮﯾﺐ اﻧﺘﺨﺎﺑﯽ ﻧﻮرونﻫﺎی ﺣﺮﮐﺘﯽ ﻓﻮﻗﺎﻧﯽ و ﺗﺤﺘﺎﻧﯽ ﻫﻤﺮاه ﺑﺎ ﺗﺠﻤﻊ ﻏﯿﺮﻃﺒﯿﻌﯽ ﭘﺮوﺗﺌﯿﻦﻫﺎی ﯾﻮﺑﯿﮑﻮﺋﯿﺘﯿﻨﻪ ﺷﺪه ﻣﺸﺨﺺ ﻣﯽﺷﻮد. ﺑﺎ اﯾﻦ ﺣﺎل، ﻣﮑﺎﻧﯿﺴﻢﻫﺎی ﻣﻮﻟﮑﻮﻟﯽ زﯾﺮﺑﻨﺎی ﭘﺎﺗﻮژﻧﺰ ALS ﻫﻨﻮز ﺑﻪﻃﻮر ﮐﺎﻣﻞ ﺷﻨﺎﺧﺘﻪ ﻧﺸﺪه اﻧﺪ. اﺗﻮﻓﺎژی ﯾﮏ ﻣﺴﯿﺮ اﺻﻠﯽ ﺑﺮای ﺣﺬف ﺗﺠﻤﻊﻫﺎی ﭘﺮوﺗﺌﯿﻨﯽ و اﻧﺪاﻣﮏﻫﺎی آﺳﯿﺐدﯾﺪه اﺳﺖ و ﺑﻨﺎﺑﺮاﯾﻦ ﺑﻪ ﻫﻤﻮﺳﺘﺎز ﺳﻠﻮﻟﯽ ﮐﻤﮏ ﻣﯽﮐﻨﺪ. اﯾﻦ ﻓﺮآﯾﻨﺪ ﮐﺎﺗﺎﺑﻮﻟﯿﮏ ﺑﺎ ﺗﺸﮑﯿﻞ اﺗﻮﻓﺎﮔﻮزومﻫﺎی دوﻏﺸﺎﯾﯽ آﻏﺎز ﻣﯽﺷﻮد ﮐﻪ ﺑﺨﺶﻫﺎﯾﯽ از ﺳﯿﺘﻮﭘﻼﺳﻢ را در ﺑﺮ ﻣﯽﮔﯿﺮﻧﺪ و ﺳﭙﺲ ﺑﺎ ﻟﯿﺰوزوم ادﻏﺎم ﻣﯽﺷﻮﻧﺪ ﺗﺎ اﺗﻮﻟﯿﺰوزوم را ﺗﺸﮑﯿﻞ دﻫﻨﺪ. در اﺗﻮﻟﯿﺰوزوم، آﻧﺰﯾﻢﻫﺎی ﻟﯿﺰوزوﻣﯽ، ﺳﻮﺑﺴﺘﺮاﻫﺎی اﺗﻮﻓﺎژی را ﻫﻀﻢ ﻣﯽﮐﻨﻨﺪ. ﻧﻘﺺ در ﻣﺮاﺣﻞ ﻣﺨﺘﻠﻒ اﺗﻮﻓﺎژی ﺑﺎ ﺟﻬﺶﻫﺎی ﭘﺎﺗﻮﻟﻮژﯾﮏ ﭼﻨﺪﯾﻦ ژن ﻣﺮﺗﺒﻂ ﺑﺎ ALS، از ﺟﻤﻠﻪ TDP-43،p62 ،SOD1 و اﭘﺘﯿﻨﻮرﯾﻦ، ﻣﺮﺗﺒﻂ ﺷﺪه اﺳﺖ ﮐﻪ ﻧﺸﺎن ﻣﯽدﻫﺪ ﭼﻨﯿﻦ ﻧﻘﺺﻫﺎﯾﯽ ﻣﻤﮑﻦ اﺳﺖ ﻧﻘﺶ ﻋﻠّﯽ در ﭘﺎﺗﻮژﻧﺰ اﯾﻦ ﺑﯿﻤﺎری داﺷﺘﻪ ﺑﺎﺷﻨﺪ.

اﺗﻮﻓﺎژی و ﺑﯿﻤﺎری [1]MS :
MS ﯾﮏ ﺑﯿﻤﺎری دِﻣﯿﻠﯿﻨﻪﮐﻨﻨﺪه ﭘﯿﺸﺮوﻧﺪه و ﻣﺰﻣﻦ ﺳﯿﺴﺘﻢ ﻋﺼﺒﯽ ﻣﺮﮐﺰی اﺳﺖ ﮐﻪ ﺑﻪ دﻟﯿﻞ اﻓﺰاﯾﺶ ﻟﻨﻔﻮﺳﯿﺖﻫﺎی T ﺧﻮدواﮐﻨﺸﯽ ﻏﯿﺮﻃﺒﯿﻌﯽ در ﻣﺤﯿﻂ ﭘﯿﺮاﻣﻮﻧﯽ اﯾﺠﺎد ﻣﯽﺷﻮد و ﺑﺎﻋﺚ ﺑﺮوز ﺧﻮداﯾﻤﻨﯽ ﻣﯽﮔﺮدد. ﭘﺎﺗﻮﻓﯿﺰﯾﻮﻟﻮژی اﺻﻠﯽ MS ﺷﺎﻣﻞ آﺳﯿﺐ ﺑﻪ ﻏﻼف ﻣﯿﻠﯿﻦ ﺗﻮﺳﻂ ﺳﻠﻮلﻫﺎی اﯾﻤﻨﯽ و اﺧﺘﻼل در ﺗﻮﻟﯿﺪ ﻣﯿﻠﯿﻦ ﺗﻮﺳﻂ اﻟﯿﮕﻮدﻧﺪروﺳﯿﺖﻫﺎ اﺳﺖ. ﻣﺎﮐﺮواﺗﻮﻓﺎژی / اﺗﻮﻓﺎژی ﯾﮏ ﻓﺮآﯾﻨﺪ ﺗﺨﺮﯾﺒﯽ ﺣﯿﺎﺗﯽ اﺳﺖ ﮐﻪ اﺟﺰای ﺳﻠﻮﻟﯽ ﻧﺎﮐﺎرآﻣﺪ ﯾﺎ اﺿﺎﻓﯽ را ﺣﺬف ﻣﯽﮐﻨﺪ. اﺗﻮﻓﺎژی در MS ﺑﻪﻋﻨﻮان ﯾﮏ ﺷﻤﺸﯿﺮ دو ﻟﺒﻪ ﻋﻤﻞ ﻣﯽﮐﻨﺪ، ﺑﻪ اﯾﻦ ﻣﻌﻨﺎ ﮐﻪ ﻣﻤﮑﻦ اﺳﺖ ﻫﻢ اﺛﺮات ﻣﻔﯿﺪ و ﻫﻢ اﺛﺮات ﻣﻀﺮ ﺑﺮ ﻧﻮروﭘﺎﺗﻮﻟﻮژی MS داﺷﺘﻪ ﺑﺎﺷﺪ. اﺗﻮﻓﺎژی ﺑﺎ ﮐﺎﻫﺶ اﺳﺘﺮس اﮐﺴﯿﺪاﺗﯿﻮ و اﺧﺘﻼﻻت اﻟﺘﻬﺎﺑﯽ، از ﭘﯿﺸﺮﻓﺖ اﯾﻦ ﺑﯿﻤﺎری ﺟﻠﻮﮔﯿﺮی ﻣﯽﮐﻨﺪ. در ﻣﻘﺎﺑﻞ، اﺗﻮﻓﺎژی ﺑﯿﺶ از ﺣﺪ ﻓﻌﺎل ﺑﺎ ﭘﯿﺸﺮﻓﺖ ﻧﻮروﭘﺎﺗﻮﻟﻮژی ﻣﺮﺗﺒﻂ اﺳﺖ و در اﯾﻦ ﻣﻮرد، اﺳﺘﻔﺎده از ﻣﻬﺎرﮐﻨﻨﺪهﻫﺎی اﺗﻮﻓﺎژی ﻣﻤﮑﻦ اﺳﺖ ﭘﺎﺗﻮژﻧﺰ MS را ﮐﺎﻫﺶ دﻫﺪ. ﻋﻼوه ﺑﺮ اﯾﻦ، اﺗﻮﻓﺎژی ﺑﺎﻋﺚ ﻓﻌﺎلﺳﺎزی ﺳﻠﻮلﻫﺎی اﯾﻤﻨﯽ و ﺳﻠﻮلﻫﺎی ﭘﺸﺘﯿﺒﺎن ﻣﺨﺘﻠﻒ ﻣﯽﺷﻮد ﮐﻪ ﻧﻘﺶ ﭘﯿﭽﯿﺪه ای در ﭘﺎﺗﻮژﻧﺰ MS اﯾﻔﺎ ﻣﯽﮐﻨﻨﺪ. اﺗﻮﻓﺎژی ﺑﺎ ﺗﻨﻈﯿﻢ ﺗﮑﺜﯿﺮ ﺳﻠﻮﻟﯽ ﻣﺮﺗﺒﻂ ﺑﺎ دِﻣﯿﻠﯿﻨﻪﺷﺪن و رِﻣﯿﻠﯿﻨﻪﺷﺪن، در ﺗﻌﺪﯾﻞ ﻧﻮروﭘﺎﺗﻮﻟﻮژی MS ﻧﻘﺶ دارد. اﺗﻮﻓﺎژی ﺑﺎ اﻓﺰاﯾﺶ ﻓﻌﺎﻟﯿﺖ اﻟﯿﮕﻮدﻧﺪروﺳﯿﺖﻫﺎ و آﺳﺘﺮوﺳﯿﺖﻫﺎ، رِﻣﯿﻠﯿﻨﻪﺷﺪن را ﺗﻘﻮﯾﺖ ﻣﯽﮐﻨﺪ. ﺑﺎ اﯾﻦ ﺣﺎل، اﺗﻮﻓﺎژی ﺑﺎ ﻓﻌﺎلﺳﺎزی ﻣﯿﮑﺮوﮔﻠﯿﺎ و ﺳﻠﻮلﻫﺎی T ﺑﺎﻋﺚ دِﻣﯿﻠﯿﻨﻪﺷﺪن ﻣﯽﺷﻮد. در ﻧﺘﯿﺠﻪ، ﻓﻌﺎلﮐﻨﻨﺪهﻫﺎی اﺧﺘﺼﺎﺻﯽ اﺗﻮﻓﺎژی ﺑﺮای اﻟﯿﮕﻮدﻧﺪروﺳﯿﺖﻫﺎ و آﺳﺘﺮوﺳﯿﺖﻫﺎ و ﻣﻬﺎرﮐﻨﻨﺪهﻫﺎی اﺧﺘﺼﺎﺻﯽ اﺗﻮﻓﺎژی ﺑﺮای ﺳﻠﻮلﻫﺎی دﻧﺪرﯾﺘﯿﮏ، ﻣﯿﮑﺮوﮔﻠﯿﺎ و ﺳﻠﻮلﻫﺎی T ﻣﯽﺗﻮاﻧﻨﺪ اﺛﺮات ﻣﺤﺎﻓﻈﺘﯽ در ﺑﺮاﺑﺮ ﭘﺎﺗﻮژﻧﺰ MS اﯾﺠﺎد ﮐﻨﻨﺪ.
اتوفاژی و بیماری افسردگی:
اﺧﺘﻼل اﻓﺴﺮدﮔﯽ اﺳﺎﺳﯽ ﯾﮏ ﺑﯿﻤﺎری ﭘﯿﭽﯿﺪه و ﭼﻨﺪﻋﺎﻣﻠﯽ اﺳﺖ ﮐﻪ ﺑﺎ ﻋﻼﺋﻤﯽ ﻣﺎﻧﻨﺪ ﺧﻠﻖ اﻓﺴﺮده، آﻧﻬﺪوﻧﯿﺎ (ﮐﺎﻫﺶ ﻟﺬت)، ﺧﺴﺘﮕﯽ و اﺧﺘﻼل در ﻋﻤﻠﮑﺮد ﺷﻨﺎﺧﺘﯽ ﻣﺸﺨﺺ ﻣﯽﺷﻮد. اﺧﯿﺮاً، ﻣﻄﺎﻟﻌﺎت ﻣﺘﻌﺪدی ﻧﺸﺎن داده اﻧﺪ ﮐﻪ داروﻫﺎی ﺿﺪاﻓﺴﺮدﮔﯽ ﺑﺮ ﺗﻨﻈﯿﻢ اﺗﻮﻓﺎژی ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارﻧﺪ. در واﻗﻊ، اﺗﻮﻓﺎژی ﺑﻪﻋﻨﻮان ﯾﮏ ﻣﺴﯿﺮ ﺗﺨﺮﯾﺒﯽ واﺑﺴﺘﻪ ﺑﻪ ﻟﯿﺰوزوم، ﺑﺮای ﻋﻤﻠﮑﺮد ﺳﯿﺴﺘﻢ ﻋﺼﺒﯽ ﻣﺮﮐﺰی ﺿﺮوری اﺳﺖ. اﺧﺘﻼل در ﻣﺴﯿﺮﻫﺎی اﺗﻮﻓﺎژی، از ﺟﻤﻠﻪ ﻣﺴﯿﺮ ﺳﯿﮕﻨﺎﻟﯿﻨﮓ MTOR و ﻣﺴﯿﺮ BECLIN، در ﺑﯿﻤﺎریﻫﺎی ﻧﻮرودژﻧﺮاﺗﯿﻮ ﻣﻮرد ﻣﻄﺎﻟﻌﻪ ﻗﺮار ﮔﺮﻓﺘﻪ اﺳﺖ. داروﻫﺎی ﺿﺪاﻓﺴﺮدﮔﯽ ﺑﻪﻃﻮر ﻣﻌﻤﻮل در درﻣﺎن ﺑﯿﻤﺎران ﺳﺮﻃﺎﻧﯽ ﻣﺒﺘﻼ ﺑﻪ اﻓﺴﺮدﮔﯽ اﺳﺘﻔﺎده ﻣﯽﺷﻮﻧﺪ، و ﻣﮑﺎﻧﯿﺴﻢﻫﺎی زﯾﺮﺑﻨﺎﯾﯽ اﯾﻦ داروﻫﺎ ﻧﯿﺰ ﺑﺎ اﻟﻘﺎی اﺗﻮﻓﺎژی ﻣﺮﺗﺒﻂ ﻫﺴﺘﻨﺪ. ﺳﻄﻮح اﻓﺰاﯾﺶﯾﺎﻓﺘﻪ ﭘﺮوﺗﺌﯿﻦ اﺗﻮﻓﺎژﯾﮏ BECLIN-1 و ﺗﻮزﯾﻊ ﻣﺠﺪد ﺳﻠﻮﻟﯽ ﻧﺸﺎﻧﮕﺮ LC3 در ﺳﻠﻮلﻫﺎی ﮔﻠﯿﻮم C6 ﮐﻪ ﺑﺎ داروی ﺿﺪاﻓﺴﺮدﮔﯽ دﺳﯿﭙﺮاﻣﯿﻦ ﺗﯿﻤﺎر ﺷﺪه اﻧﺪ، ﻣﺸﺎﻫﺪه ﺷﺪه اﺳﺖ. اﯾﻦ دارو ﺑﺎ ﺗﺸﮑﯿﻞ اﺗﻮﻓﺎﮔﻮزومﻫﺎ، ﻣﺮگ ﺳﻠﻮﻟﯽ اﺗﻮﻓﺎژﯾﮏ را اﻟﻘﺎ ﻣﯽﮐﻨﺪ. داروی ﺿﺪاﻓﺴﺮدﮔﯽ ﺳﻪﺣﻠﻘﻪای اﯾﻤﯽ ﭘﺮاﻣﯿﻦ، ﭘﯿﺸﺮﻓﺖ اﺗﻮﻓﺎژی را ﺗﺤﺮﯾﮏ ﮐﺮده و ﺑﺎ ﻣﻬﺎر ﻣﺴﯿﺮ ﺳﯿﮕﻨﺎﻟﯿﻨﮓ PI3K-AKT-MTOR و اﻟﻘﺎی ﻣﺮگ ﺳﻠﻮﻟﯽ اﺗﻮﻓﺎژﯾﮏ، اﺛﺮات ﺿﺪﺗﻮﻣﻮری در ﺳﻠﻮلﻫﺎی ﮔﻠﯿﻮم اﻧﺴﺎﻧﯽ U-87MG ﻓﺎﻗﺪ PTEN اﻋﻤﺎل ﻣﯽﮐﻨﺪ. داروﻫﺎی ﺿﺪاﻓﺴﺮدﮔﯽ ﻣﺎﭘﺮوﺗﯿﻠﯿﻦ و ﻓﻠﻮﮐﺴﺘﯿﻦ، ﮐﻪ ﺑﻪﻋﻨﻮان ﻋﻮاﻣﻞ ﭘﯿﺶﺑﺮﻧﺪه اﺗﻮﻓﺎژی ﺷﻨﺎﺧﺘﻪ ﻣﯽﺷﻮﻧﺪ، ﻣﺮگ ﺑﺮﻧﺎﻣﻪرﯾﺰیﺷﺪه ﺳﻠﻮﻟﯽ اﺗﻮﻓﺎژﯾﮏ را در ﺧﻂ ﺳﻠﻮﻟﯽ DG-75 ﻟﻨﻔﻮم ﺑﻮرﮐﯿﺖ ﻣﻘﺎوم ﺑﻪ ﺷﯿﻤﯽدرﻣﺎﻧﯽ اﻟﻘﺎ ﻣﯽﮐﻨﻨﺪ. اﯾﻦ ﻓﺮآﯾﻨﺪ واﺑﺴﺘﻪ ﺑﻪ ﮐﺎﺳﭙﺎزﻫﺎ، ﻗﻄﻌﻪﻗﻄﻌﻪﺷﺪن DNA ﯾﺎ ﺑﺮش PARP ﻧﯿﺴﺖ، اﻣﺎ ﺑﺎ ﺗﺸﮑﯿﻞ واﮐﻮﺋﻞﻫﺎی ﺳﯿﺘﻮﭘﻼﺳﻤﯽ ﻫﻤﺮاه اﺳﺖ ﮐﻪ ﻫﻤﮕﯽ ﺑﺎ اﻟﮕﻮی اﺗﻮﻓﺎژﯾﮏ ﻣﺮگ ﺑﺮﻧﺎﻣﻪرﯾﺰیﺷﺪه ﺳﻠﻮﻟﯽ ﺳﺎزﮔﺎر ﻫﺴﺘﻨﺪ. ﺑﻨﺎﺑﺮاﯾﻦ، ﻣﮑﺎﻧﯿﺴﻢﻫﺎی آﻏﺎزﮐﻨﻨﺪه اﺗﻮﻓﺎژی ﺑﻪﻋﻨﻮان ﯾﮏ ﻫﺪف داروﯾﯽ ﺑﺮای ﺑﻬﺒﻮد درﻣﺎن اﻓﺴﺮدﮔﯽ در ﻧﻈﺮ ﮔﺮﻓﺘﻪ ﻣﯽ ﺷﻮﻧﺪ.
ﻣﻨﺎﺑﻊ:
1. MOULIS M, VINDIS C. 2018. AUTOPHAGY IN METABOLIC AGE- RELATED HUMAN DISEASES. CELLS,7(10), 149.
2. RAVIKUMAR B, SARKAR S, DAVIES JE, FUTTER M, GARCIA- ARENCIBIA M, GREEN-THOMPSON ZW, ET AL. 2010. REGULATION OF MAMMALIAN AUTOPHAGY IN PHYSIOLOGY AND PATHOPHYSIOLOGY. PHYSIOLOGICAL REVIEWS, 90(4), 1383-435.
3. DOHERTY J, BAEHRECKE EH. 2018. LIFE, DEATH AND AUTOPHAGY. NATURE CELL BIOLOGY, 20(10), 1110-7.
4. MADEO F, TAVERNARAKIS N, KROEMER G. 2010, CAN AUTOPHAGY PROMOTE LONGEVITY? NATURE CELL BIOLOGY, 12(9), 842-6.
5. PALMER JE, WILSON N, SON SM, OBROCKI P, WROBEL L, ROB M, ET AL. 2025. AUTOPHAGY, AGING, AND AGE-RELATED NEURODEGENERATION. NEURON,113(1), 29-48.
6. PURI C, GRATIAN MJ, RUBINSZTEIN DC. 2023. MAMMALIAN AUTOPHAGOSOMES FORM FROM FINGER-LIKE PHAGOPHORES. DEVELOPMENTAL CELL, 58(23), 2746-60.
7. KANG C, XU Q, MARTIN TD, LI MZ, DEMARIA M, ARON L, ET AL. 2015. THE DNA DAMAGE RESPONSE INDUCES INFLAMMATION AND SENESCENCE BY INHIBITING AUTOPHAGY OF GATA4. SCIENCE.349(6255):AAA5612.
8. AMAN Y, SCHMAUCK-MEDINA T, HANSEN M, MORIMOTO RI, SIMON AK, BJEDOV I, ET AL. 2021. AUTOPHAGY IN HEALTHY AGING AND DISEASE. NATURE AGING, 1(8), 634-50
9. LI Q, LIU Y, SUN M. 2017. AUTOPHAGY AND ALZHEIMER’S DISEASE. CELLULAR AND MOLECULAR NEUROBIOLOGY, 37, 377-88.
10. LU J, WU M, YUE Z. 2020. AUTOPHAGY AND PARKINSON’S DISEASE. AUTOPHAGY: BIOLOGY AND DISEASES: CLINICAL SCIENCE, 21-51.
11. LEE JK, SHIN JH, LEE JE, CHOI E-J. 2015. ROLE OF AUTOPHAGY IN THE PATHOGENESIS OF AMYOTROPHIC LATERAL SCLEROSIS. BIOCHIMICA ET BIOPHYSICA ACTA (BBA)-MOLECULAR BASIS OF DISEASE, 1852(11), 2517-24.
12. AL-KURAISHY HM, JABIR MS, AL-GAREEB AI, SAAD HM, BATIHA GE-S, KLIONSKY DJ. 2024. THE BENEFICIAL ROLE OF AUTOPHAGY IN MULTIPLE SCLEROSIS: YES OR NO? AUTOPHAGY, 20(2), 259-74.
13. JIA J, LE W. 2015. MOLECULAR NETWORK OF NEURONAL AUTOPHAGY IN THE PATHOPHYSIOLOGY AND TREATMENT OF DEPRESSION. NEUROSCIENCE BULLETIN, 31, 427-34.
14. MA J, HOU L-N, RONG Z-X, LIANG P, FANG C, LI H-F, ET AL. 2013. ANTIDEPRESSANT DESIPRAMINE LEADS TO C6 GLIOMA CELL AUTOPHAGY: IMPLICATION FOR THE ADJUVANT THERAPY OF CANCER. ANTI-CANCER AGENTS IN MEDICINAL CHEMISTRY (FORMERLY CURRENT MEDICINAL CHEMISTRY-ANTI-CANCER AGENTS), 13(2), 254-60.
15. JEON S-H, KIM SH, KIM Y, KIM YS, LIM Y, LEE YH, ET AL. 2011. THE TRICYCLIC ANTIDEPRESSANT IMIPRAMINE INDUCES AUTOPHAGIC CELL DEATH IN U-87MG GLIOMA CELLS. BIOCHEMICAL AND BIOPHYSICAL RESEARCH COMMUNICATIONS, 413(2), 311-7.
16. CLOONAN SM, WILLIAMS DC. 2011. THE ANTIDEPRESSANTS MAPROTILINE AND FLUOXETINE INDUCE TYPE II AUTOPHAGIC CELL DEATH IN DRUG‐RESISTANT BURKITT'S LYMPHOMA. INTERNATIONAL JOURNAL OF CANCER, 128(7), 1712-23.
Footnote:
[1] phagophore
[2] senescence
[3] Amyotrophic Lateral Sclerosis
[4] Multiple Sclerosis
ﮔﺮدآوری و ﺑﺎزﻧﻮﯾﺴﯽ: ﻣﺤﻤﺪ ﮐﺎرﮔﺮ
داﻧﺸﺠﻮی دﮐﺘﺮی ﻋﻠﻮم اﻋﺼﺎب داﻧﺸﮕﺎه ﻋﻠﻮم ﭘﺰﺷﮑﯽ ﺷﻬﯿﺪ ﺑﻬﺸﺘﯽ

