ﺑﯿﻤﺎریﻫﺎﯾﯽ ﺑﺎ ﺗﻈﺎﻫﺮات ﻋﺼﺐﺷﻨﺎﺳﯽ: ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز و آﮐﻨﺪروﭘﻼزی
ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز، ﺑﯿﻤﺎری ﻋﻔﻮﻧﯽ اﺳﺖ ﮐﻪ ﺗﻮﺳﻂ ﺗﮏ ﯾﺎﺧﺘﻪ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ ﮔﻮﻧﺪی [1] ﺑﻪ وﺟﻮد ﻣﯽآﯾﺪ. ﻣﯿﺰان ﺷﯿﻮع اﯾﻦ اﻧﮕﻞ در ﻣﯿﺎن اﻧﺴﺎنﻫﺎ 25 درﺻﺪ اﺳﺖ. ﺑﻪ ﻃﻮر ﮐﻠﯽ، ﺳﻪ دﺳﺘﻪ از اﯾﻦ اﻧﮕﻞ وﺟﻮد دارد: اووﺳﯿﺴﺘﻬﺎ، ﺗﺎﮐﯽ زوﺋﯿﺘﻬﺎ و ﺑﺮادی زوﺋﯿﺖﻫﺎ. اووﺳﯿﺴﺖﻫﺎ در ﺧﺎﻧﻮادهٔ ﮔﺮﺑﻪ ﺳﺎﻧﺎن رﺷﺪ ﻣﯿﮑﻨﻨﺪ و ﺑﻪ ﺗﺎﮐﯽ زوﺋﯿﺖ ﺗﺒﺪﯾﻞ ﻣﯿﺸﻮﻧﺪ. ﺗﺎﮐﯽ زوﺋﯿﺘﻬﺎ ﺑﻪ ﻋﻨﻮان ﺷﮑﻞ ﺳﺮﯾﻊ ﺗﮑﺜﯿﺮﺷﻮﻧﺪهٔ اﯾﻦ اﻧﮕﻞ ﺑﻪ ﺑﺮادی زوﺋﯿﺘﻬﺎ ﺗﻤﺎﯾﺰ ﯾﺎﻓﺘﻪ، و ﺑﻪ ﺳﻠﻮلﻫﺎی ﻋﺼﺒﯽ ﺣﻤﻠﻪ ﻣﯽﮐﻨﻨﺪ. ﺑﺮادﯾﺰوﺋﯿﺖﻫﺎ در ﻃﻮل زﻧﺪﮔﯽ ﺑﻪ ﻋﻨﻮان ﯾﮏ ﻓﺎز ﻧﻬﻔﺘﻪ ﻣﺰﻣﻦ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز در ﺳﻠﻮلﻫﺎ ﺑﺎﻗﯽ ﻣﯽﻣﺎﻧﻨﺪ. ﭘﮋوﻫﺶﻫﺎی اﻧﺴﺎﻧﯽ و ﺣﯿﻮاﻧﯽ ﻧﺸﺎن داده اﻧﺪ ﮐﻪ ﻋﻔﻮﻧﺖ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ ﻣﯽﺗﻮاﻧﺪ ﻣﻨﺠﺮ ﺑﻪ اﺧﺘﻼل در ﺣﺎﻓﻈﻪ و ﯾﺎدﮔﯿﺮی، و ﻧﯿﺰ ﺗﺮس و اﺿﻄﺮاب ﺷﻮد. ﻫﻤﭽﻨﯿﻦ اﻋﺘﻘﺎد ﺑﺮ اﯾﻦ اﺳﺖ ﮐﻪ آﻟﻮدﮔﯽ ﺑﻪ اﯾﻦ اﻧﮕﻞ ﻣﯽﺗﻮاﻧﺪ اﺳﮑﯿﺰوﻓﺮﻧﯽ، زوال ﻋﻘﻞ و اﺧﺘﻼل دوﻗﻄﺒﯽ اﯾﺠﺎد ﮐﻨﺪ.
ﻋﻼوه ﺑﺮ اﯾﻦ، ﻋﻔﻮﻧﺖﻫﺎی ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز در ﻣﻮشﻫﺎ ﺑﻪ ﺻﻮرت ﭘﺮدردی ﺑﺮوز می کند. ﺗﻐﯿﯿﺮات ﻧﺎﺷﯽ از اﻧﮕﻞ، از ﻃﺮﯾﻖ ﺷﺒﮑﻪﻫﺎی ﺳﯿﺘﻮﮐﯿﻦ، ﺳﺒﺐ اﻓﺰاﯾﺶ اﻟﺘﻬﺎﺑﺎت ﻋﺼﺒﯽ در ﺳﻠﻮﻟﻬﺎﯾﯽ ﻧﻈﯿﺮ ﺳﻠﻮلﻫﺎی ﻋﺼﺒﯽ ﻣﯽﺷﻮد. ﻋﻼوه ﺑﺮ اﯾﻦ، در ﺳﯿﺴﺘﻢ ﻋﺼﺒﯽ ﻣﺮﮐﺰی ﻣﻮشﻫﺎی ﻣﺒﺘﻼ ﺑﻪ ﻋﻔﻮﻧﺖ ﻣﺰﻣﻦ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز، ﺗﻐﯿﯿﺮاﺗﯽ در ﺳﻄﻮح ﺳﯿﻨﺎﭘﺲ و اﻧﺘﻘﺎل دﻫﻨﺪهﻫﺎی ﻋﺼﺒﯽ از ﺟﻤﻠﻪ ﺳﯿﻨﺎﭘﺲﻫﺎی ﮔﻠﻮﺗﺎﻣﺎﺗﺮژﯾﮏ و ﮔﺎﺑﺎﺋﺮژﯾﮏ ﮔﺰارش ﺷﺪه اﺳﺖ. در ﻣﻮشﻫﺎی آﻟﻮده ﺑﻪ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز، ﻋﻔﻮﻧﺖ ﺷﺮوع ﺑﻪ ﻓﻌﺎلﺳﺎزی ﻣﯿﮑﺮوﮔﻠﯿﺎ در ﻧﻮرونﻫﺎی ﮔﻠﻮﺗﺎﻣﺎﺗﺮژﯾﮏ و ﮔﺎﺑﺎﺋﺮژﯾﮏ ﻣﯽﮐﻨﺪ و اﺣﺘﻤﺎل ﺑﺮوز ﺑﯿﻤﺎریﻫﺎی ﺗﺨﺮﯾﺐﮐﻨﻨﺪه ی ﻋﺼﺒﯽ ﻣﺎﻧﻨﺪ اﺳﮑﯿﺰوﻓﺮﻧﯽ، آﻟﺰاﯾﻤﺮ و ﭘﺎرﮐﯿﻨﺴﻮن را ﺷﺪت ﻣﯽﺑﺨﺸﺪ. ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز ﻣﺰﻣﻦ از ﻃﺮﯾﻖ اﻓﺰاﯾﺶ اﻟﺘﻬﺎﺑﺎت ﻋﺼﺒﯽ، ﺑﻪ وﯾﮋه در ﻗﺸﺮ ﭘﯿﺶﭘﯿﺸﺎﻧﯽ، ﻗﺸﺮ ﺳﯿﻨﮕﻮﻟﯿﺖ ﻗﺪاﻣﯽ و ﻗﺸﺮ ﺟﺴﻤﯽ ﺣﺮﮐﺘﯽ، ﺗﺨﺮﯾﺐ ﻋﺼﺒﯽ ﺑﺎﻻﯾﯽ را اﯾﺠﺎد ﻣﯽﮐﻨﺪ. ﻫﻤﭽﻨﯿﻦ، ﭘﮋوﻫﺸﮕﺮان ﮐﺎﻫﺶ ﭘﺮوﺗﺌﯿﻦﻫﺎی ﭘﯿﺶﺳﯿﻨﺎﭘﺴﯽ و ﭘﺲﺳﯿﻨﺎﭘﺴﯽ ﮔﯿﺮﻧﺪهﻫﺎی ﮔﻠﻮﺗﺎﻣﺎت ﻣﺎﻧﻨﺪ ﮔﯿﺮﻧﺪهﻫﺎی α-آﻣﯿﻨﻮ-3-ﻫﯿﺪروﮐﺴﯽ-5-ﻣﺘﯿﻞ-4-اﯾﺰوﮐﺴﺎزول ﭘﺮوﭘﯿﻮﻧﯿﮏ اﺳﯿﺪ [2] و ﮔﯿﺮﻧﺪهﻫﺎی -Nﻣﺘﯿﻞ-D-آﺳﭙﺎرﺗﺎت [3] را ﮔﺰارش ﮐﺮده اﻧﺪ.
اﯾﻦ ﭘﺮوﺗﺌﯿﻦﻫﺎ ﺷﺎﻣﻞ زﯾﺮواﺣﺪﻫﺎی ﮔﯿﺮﻧﺪه ی AMPA GluA1 ،GluA2 و زﯾﺮواﺣﺪﻫﺎی ﮔﯿﺮﻧﺪه ی NMDA GluN2B، GluN1 ﻫﺴﺘﻨﺪ ﮐﻪ ﻋﻤﻠﮑﺮدﻫﺎی ﻋﺼﺒﯽ در ﻫﯿﭙﻮﮐﺎﻣﭗ ﻣﺎﻧﻨﺪ ﺗﺸﮑﯿﻞ ﺳﯿﻨﺎﭘﺲ، اﻧﺘﻘﺎل ﺳﯿﻨﺎﭘﺴﯽ، ﺗﺴﻬﯿﻞ ﺳﯿﻨﺎﭘﺴﯽ و ﻫﺮس ﺳﯿﻨﺎﭘﺴﯽ را ﺗﻐﯿﯿﺮ ﻣﯽدﻫﻨﺪ. ﻋﻼوه ﺑﺮ اﯾﻦ، ﺳﯿﻨﺎﭘﺘﻮﻓﯿﺰﯾﻦ [4] (ﭘﺮوﺗﺌﯿﻨﯽ ﺑﺎ ﭼﮕﺎﻟﯽ ﭘﺲ ﺳﯿﻨﺎﭘﺴﯽ) و اﻧﺘﻘﺎل دﻫﻨﺪهٔ اﺳﯿﺪ آﻣﯿﻨﻪ ﺗﺤﺮﯾﮑﯽ 2 [5] (ﮐﻪ در ﻗﺪرت اﻧﺘﻘﺎل ﺳﯿﻨﺎﭘﺴﯽ در ﻣﺪارﻫﺎی ﺳﯿﻨﺎﭘﺴﯽ ﻧﻘﺶ دارد) ﮐﻪ در اﻟﻘﺎی [6] LTP و [7] LTD در ﻫﯿﭙﻮﮐﺎﻣﭗ ﻧﻘﺶ دارﻧﺪ، در ﺗﻮﮐﺴﻮﭘﻼﺳﻤﻮز ﻧﻬﻔﺘﻪ ﻫﺴﺘﻨﺪ. ﺑﻨﺎﺑﺮاﯾﻦ، ﻋﻮاﻣﻞ ﻋﻔﻮﻧﺖ ﻣﺎﻧﻨﺪ اﻧﮕﻞﻫﺎ ﺑﺮ ﺳﺎﺧﺘﺎر و ﻋﻤﻠﮑﺮد ﺳﯿﺴﺘﻢ ﻋﺼﺒﯽ ﻣﺮﮐﺰی اﺛﺮ ﮔﺬارﻧﺪ.
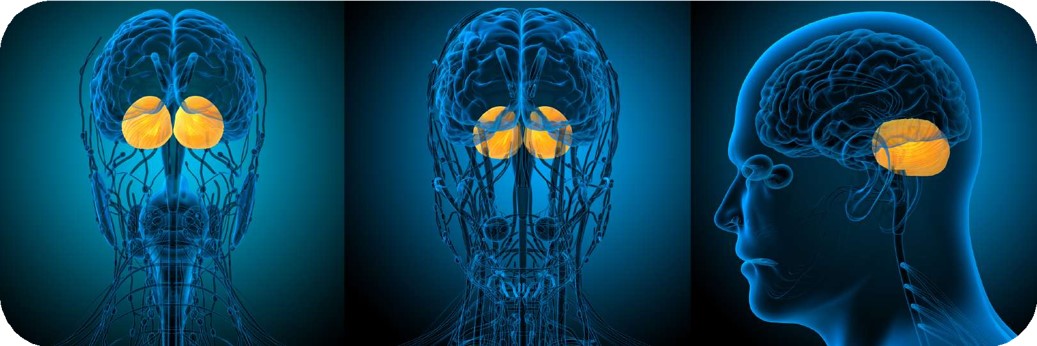
از ﺳﻮﯾﯽ دﯾﮕﺮ، ﻋﻔﻮﻧﺖ ﺣﺎد و ﻣﺰﻣﻦ اﯾﻦ اﻧﮕﻞ ﺑﺮ ﺑﺮوز ﺗﺮس ﺗﺄﺛﯿﺮ ﻣﯽﮔﺬارد. ﺗﺮس در ﭘﺴﺘﺎﻧﺪاران ﭘﺎﺳﺨﯽ دﻓﺎﻋﯽ در ﺑﺮاﺑﺮ ﺗﻬﺪﯾﺪات و ﻣﺤﺮﮐﯽ ﺑﯿﺮوﻧﯽ ﺑﺮای ﺳﺎزﮔﺎر ﺷﺪن ﺑﺎ ﻣﺤﯿﻂ اﺳﺖ. بی نظمی در ﻣﮑﺎﻧﯿﺴﻢﻫﺎی ﺗﺮس، ﻧﻘﺶ ﻋﻤﺪه ای در ﭘﺎﺗﻮﻓﯿﺰﯾﻮﻟﻮژی اﺧﺘﻼﻻت ﺷﻨﺎﺧﺘﯽ دارد. در دﺳﺘﮕﺎه ﻋﺼﺒﯽ ﻣﺮﮐﺰی ﭘﺴﺘﺎﻧﺪاران، آﻣﯿﮕﺪال ﻧﻘﺶ ﻣﻬﻤﯽ را در ﻧﻮروﺑﯿﻮﻟﻮژی ﺗﺮس اﯾﻔﺎ ﻣﯽﮐﻨﺪ. اﺧﺘﻼل در ﻣﺪار آﻣﯿﮕﺪال ﻣﻤﮑﻦ اﺳﺖ اﻓﺴﺮدﮔﯽ، ﻓﻮﺑﯿﺎ و اﺧﺘﻼل اﺳﺘﺮس ﭘﺲ از ﺣﺎدﺛﻪ را ﺑﻪ دﻧﺒﺎل داﺷﺘﻪ ﺑﺎﺷﺪ. در ﻣﻮشﻫﺎی ﺻﺤﺮاﯾﯽ، ﻋﻔﻮﻧﺖ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ ﻣﯿﺘﻮاﻧﺪ اﻟﺘﻬﺎب ﻋﺼﺒﯽ ﻧﺎﺷﯽ از ﺗﺮس را ﻣﻬﺎر ﮐﻨﺪ. ﺑﻪ ﻃﻮر ﻃﺒﯿﻌﯽ، ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ در آﻣﯿﮕﺪال ﻗﺎﻋﺪهای ﺟﺎﻧﺒﯽ ﺑﺎ ﮐﺎﻫﺶ ﺗﺮﺷﺢ ﮐﻮرﺗﯿﮑﻮﺳﺖ از ﺷﺮوع ﺗﺮس ﺟﻠﻮﮔﯿﺮی ﻣﯿﮑﻨﺪ. در اﯾﻦ راﺳﺘﺎ، در ﺣﺎﻟﯿﮑﻪ ﺑﺮﺧﯽ ﭘﮋوﻫﺸﮕﺮان ارﺗﺒﺎﻃﯽ ﻣﯿﺎن ﺗﺮس و ﻋﻔﻮﻧﺖ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ ﻧﯿﺎﻓﺘﻪاﻧﺪ، ﺑﺮﺧﯽ دﯾﮕﺮ اﯾﻦ ﻋﻔﻮﻧﺖ را ﻫﻤﺮاه ﺑﺎ ﺗﻐﯿﯿﺮ در ﻧﻮرون ﻫﺎی DA در آﻣﯿﮕﺪال ﻣﺮﮐﺰی و ﺑﺮوز ﻃﯿﻒ وﺳﯿﻌﯽ از رﻓﺘﺎرﻫﺎ ﻣﺎﻧﻨﺪ اﺿﻄﺮاب و ﺗﺮس ﺑﺮﺷﻤﺮده اﻧﺪ. در ﻧﻬﺎﯾﺖ، ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ ﻣﯿﺘﻮاﻧﺪ ﺑﺎ ﺗﻐﯿﯿﺮ در ﺷﺒﮑﻪﻫﺎی ﻋﺼﺒﯽ، ﺳﺒﺐ ﺑﺮوز اﺧﺘﻼﻻت ﺣﺎﻓﻈﻪ ﻧﻈﯿﺮ زوال ﻋﻘﻞ ﺷﻮد و ﺣﺎﻓﻈﻪی ﻓﻌﺎل را ﻣﺨﺘﻞ ﻧﻤﺎﯾﺪ. ﺷﺮوع ﻋﻔﻮﻧﺖ ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ در ﭘﯿﺮی ﻣﯿﺘﻮاﻧﺪ ﭘﻠﯽﻣﻮرﻓﯿﺴﻢﻫﺎی ژﻧﺘﯿﮑﯽ را ﺗﻘﻮﯾﺖ ﮐﻨﺪ، و در ﻧﺘﯿﺠﻪ، اﺧﺘﻼل ﻋﻤﻠﮑﺮدی را در ﺣﺎﻓﻈﻪ روﯾﺪادی و ﮐﺎری رﻗﻢ ﺑﺰﻧﺪ. ﻫﻤﭽﻨﯿﻦ، ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ از ﻃﺮﯾﻖ ﮐﺎﻫﺶ ﻧﻮﺳﺎن ﺗﺘﺎ در ﭘﯿﺮی، ﻋﻤﻠﮑﺮد ﺣﺎﻓﻈﻪی ﮐﺎری را دﭼﺎر اﺧﺘﻼل ﻣﯽﮐﻨﺪ. ﺑﻨﺎﺑﺮاﯾﻦ، ﺗﻮﮐﺴﻮﭘﻼﺳﻤﺎ ﻣﻤﮑﻦ اﺳﺖ ﺑﺎ اﯾﺠﺎد اﯾﻦ ﺗﻐﯿﯿﺮات، ﺑﺮ ﯾﺎدﮔﯿﺮی و ﺣﺎﻓﻈﻪ اﺛﺮ ﺳﻮء ﺑﺮ ﺟﺎی ﺑﮕﺬارد.
ﻣﻨﺎﺑﻊ:
1. Brooks, J. M., Carrillo, G. L., Su, J., Lindsay, D. S., Fox, M. A., & Blader, I. J. (2015). Toxoplasma gondii infections alter GABAergic synapses and signaling in the central nervous system. MBio, 6(6), 10-1128.
2. David, C. N., Frias, E. S., Szu, J. I., Vieira, P. A., Hubbard, J. A., Lovelace, J., & Wilson, E. H. (2016). GLT-1-dependent disruption of CNS glutamate homeostasis and neuronal function by the protozoan parasite Toxoplasma gondii. PLoS Pathogens, 12(6), e1005643.
3. French, T., Düsedau, H. P., Steffen, J., Biswas, A., Ahmed, N., Hartmann, S., & Dunay, I. R. (2019). Neuronal impairment following chronic Toxoplasma gondii infection is aggravated by intestinal nematode challenge in an IFN-γ-dependent manner. Journal of Neuroinflammation, 16, 1-18.
4. Ghanbari, M. M., Joneidi, M., Kiani, B., Babaie, J., & Sayyah, M. (2020). Cannabinoid receptors and the proconvulsant effect of toxoplasmosis in mice. Microbial Pathogenesis, 144, 104204.
5. Lang, D., Schott, B. H., van Ham, M., Morton, L., Kulikovskaja, L., Herrera-Molina, R., ... & Dunay, I. R. (2018). Chronic Toxoplasma infection is associated with distinct alterations in the synaptic protein composition. Journal of Neuroinflammation, 15, 1-19.
6. Li, Y., Severance, E. G., Viscidi, R. P., Yolken, R. H., & Xiao, J. (2019). Persistent Toxoplasma infection of the brain induced neurodegeneration associated with activation of complement and microglia. Infection and Immunity, 87(8), 10-1128.
7. Mahmoudvand, H., Ziaali, N., Ghazvini, H., Shojaee, S., Keshavarz, H., Esmaeilpour, K., & Sheibani, V. (2016). Toxoplasma gondii infection promotes neuroinflammation through cytokine networks and induced hyperalgesia in BALB/c mice. Inflammation, 39, 405-412.
8. Molan, A., Nosaka, K., Hunter, M., & Wang, W. (2019). Global status of Toxoplasma gondii infection: systematic review and prevalence snapshots. Tropical Biomedicine, 36, 898-925.
9. Parlog, A., Harsan, L. A., Zagrebelsky, M., Weller, M., von Elverfeldt, D., Mawrin, C., & Dunay, I. R. (2014). Chronic murine toxoplasmosis is defined by subtle changes in neuronal connectivity. Disease Nodels & Mechanisms, 7(4), 459-469.
10. Sayehmiri, F., Motamedi, F., Batool, Z., Naderi, N., Shaerzadeh, F., Zoghi, A., ... & Pourbadie, H. G. (2024). Mitochondrial plasticity and synaptic plasticity crosstalk; in health and Alzheimer's disease. CNS Neuroscience & Therapeutics, 30(8), e14897.
11. Sutterland, A. L., Fond, G., Kuin, A., Koeter, M. W. J., Lutter, R., Van Gool, T., & De Haan, L. (2015). Beyond the association. T oxoplasma gondii in schizophrenia, bipolar disorder, and addiction: systematic review and meta‐analysis. Acta Psychiatrica Scandinavica, 132(3), 161-179.
12. Worth, A. R., Thompson, R. A., & Lymbery, A. J. (2014). Reevaluating the evidence for Toxoplasma gondii-induced behavioural changes in rodents. Advances in Parasitology, 85, 109-142.
13. Yang, H. Y., Chien, W. C., Chung, C. H., Su, R. Y., Lai, C. Y., Yang, C. C., & Tzeng, N. S. (2021). Risk of dementia in patients with toxoplasmosis: a nationwide, population-based cohort study in Taiwan. Parasites & Vectors, 14(1), 435.
Footnote:
[1] Toxoplasma gondii
[2] AMPA
[3] NMDA
[4] PSD-95
[5] EAAT2
[6] long-term potential
[7] Long-Term Depression
ﮔﺮدآوری و ﺑﺎزﻧﻮﯾﺴﯽ: ﺷﺎﯾﺎن ﻋﻠﯽ اﮐﺒﺮی
داﻧﺸﺠﻮی دﮐﺘﺮی ﻋﻠﻮم اﻋﺼﺎب

